题目内容
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为______ _%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用 (填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为 。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为 。
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(盐酸)/mL | |
| 初始读数 | 末尾读数 | ||
| 1 | 10.00 | 0.50 | 21.52 |
| 2 | 10.00 | 1.00 | 21.98 |
| 3 | 10.00 | 0.20 | 24.80 |
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为______ _%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用 (填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为 。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为 。
(1)不断振荡锥形瓶(2分);溶液的颜色刚好由浅红色变为无色,且半分钟内颜色不变化即为滴定终点(2分);84(2分);BD(2分)
(2)酸式(1分);高锰酸钾溶液有强氧化性,会腐蚀橡胶(2分);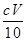 mol/L(2分)
mol/L(2分)
(2)酸式(1分);高锰酸钾溶液有强氧化性,会腐蚀橡胶(2分);
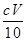 mol/L(2分)
mol/L(2分)试题分析:(1)①滴定时要保证酸碱充分混合反应,因此滴定时右手的正确操作是不断振荡锥形瓶。
②由于盐酸不能使酚酞显色,而氢氧化钠溶液可以使酚酞显红色,因此判断到达滴定终点的实验现象是溶液的颜色刚好由浅红色变为无色,且半分钟内颜色不变化即为滴定终点;根据表中数据可知,三次实验中消耗盐酸的体积分别是21.52ml-0.50ml=21.02ml、21.98ml-1.00ml=20.98ml、24.80ml-0.20ml=24.60ml。显然第三次实验中盐酸的体积误差太大,应该舍去,实验实际消耗盐酸体积的平均值是
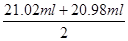 =21.00ml。所以根据NaOH+HCl=NaCl+H2O可知,10ml溶液中氢氧化钠的物质的量=0.20mol/L×0.0210L=0.0042mol。因此5.0g样品中含氢氧化钠的物质的量=
=21.00ml。所以根据NaOH+HCl=NaCl+H2O可知,10ml溶液中氢氧化钠的物质的量=0.20mol/L×0.0210L=0.0042mol。因此5.0g样品中含氢氧化钠的物质的量=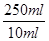 ×0.0042mol=0.105mol,其质量=0.105mol×40g/mol=4.2g,所以氢氧化钠的纯度=
×0.0042mol=0.105mol,其质量=0.105mol×40g/mol=4.2g,所以氢氧化钠的纯度=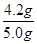 ×100%=84%。
×100%=84%。③根据
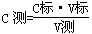 可知,由于C标、V测均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、锥形瓶用蒸馏水洗后未用待测液润洗属于正确的操作,氢氧化钠的含量不变;B、酸式滴定管用蒸馏水洗后未用标准液润洗,相当于盐酸的浓度被稀释,则消耗盐酸的体积增加,测定结果偏高;C、滴定过程中振荡锥形瓶时,有少量待测溶液溅出,则消耗盐酸的体积减少,测定结果偏低;D、滴定前平视读数,滴定结束仰视读数,则读数值偏大,因此需要盐酸的体积增加,测定结果偏高,答案选BD。
可知,由于C标、V测均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、锥形瓶用蒸馏水洗后未用待测液润洗属于正确的操作,氢氧化钠的含量不变;B、酸式滴定管用蒸馏水洗后未用标准液润洗,相当于盐酸的浓度被稀释,则消耗盐酸的体积增加,测定结果偏高;C、滴定过程中振荡锥形瓶时,有少量待测溶液溅出,则消耗盐酸的体积减少,测定结果偏低;D、滴定前平视读数,滴定结束仰视读数,则读数值偏大,因此需要盐酸的体积增加,测定结果偏高,答案选BD。(2)①过氧化氢溶液具有强氧化性,能腐蚀橡胶,应该用酸式滴定管量取。
②高锰酸钾溶液有强氧化性,会腐蚀橡胶,所以应该用酸式滴定管量取。
③消耗高锰酸钾的物质的量=0.001cVmol,则根据2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑可知,过氧化氢的物质的量=0.001cVmol×
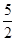 =0.0025mol,所以过氧化氢的浓度=0.0025mol÷0.025L=0.1cVmol/L。
=0.0025mol,所以过氧化氢的浓度=0.0025mol÷0.025L=0.1cVmol/L。
练习册系列答案
相关题目
 ): n(
): n( )变化的关系如下表:
)变化的关系如下表: