题目内容
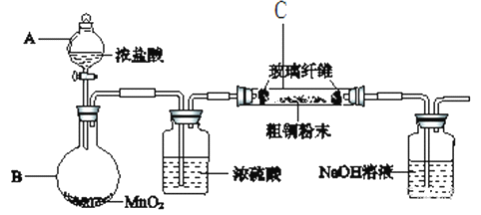
【题目】化学方程式为3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A.反应中MnO2是氧化剂
B.该反应属于复分解反应
C.KClO3在反应中失去电子
D.反应中每生成l mol K2MnO4 , 氧化剂得到2 mol电子
【答案】D
【解析】解:A.Mn元素的化合价由+4价升高为+6价,所以MnO2是还原剂,故A错误;
B.3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O中,Mn元素的化合价由+4价升高为+6价,Cl元素的化合价由+5价降低为﹣1价,所以该反应属于氧化还原反应,故B错误;
3K2MnO4+KCl+3H2O中,Mn元素的化合价由+4价升高为+6价,Cl元素的化合价由+5价降低为﹣1价,所以该反应属于氧化还原反应,故B错误;
C.Cl元素的化合价由+5价降低为﹣1价,所以KClO3在反应中得到电子,故C错误;
D.Mn元素的化合价由+4价升高为+6价,所以反应中每生成l mol K2MnO4 , 根据得失电子守恒,氧化剂得到(6﹣4)×1mol=2 mol电子,故D正确;
故选D.

练习册系列答案
相关题目
【题目】25℃,几种物质的pH和浓度如下表所示。
序号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
浓度 | c1 | c2 | c3 | c4 |
回答下列问题:
(1) c1_____(填“>”“<”或“=”) c2。
(2)溶液中水的电离程度②_____(填“>”“<”或“=”)③。
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为________(填序号)。
(4) ①溶液与④溶液等体积混合,溶液的pH_______(填“>"'<"或“=”,下同)7,混合溶液中c(NH4+)____c(Cl-)。