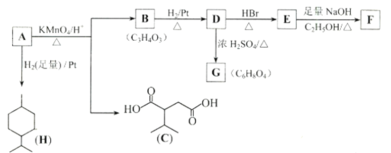
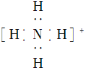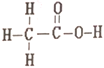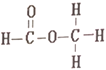��Ŀ����
����Ŀ����ͼΪʵ�������屽��װ��ͼ�����������գ�

��1���÷�Ӧ�Ļ�ѧ����ʽ��___��
��2��˫��U�ι���ʢ��CCl4����;��___��
��3��A����˿�����ã�___��
��4����Һ©����Һ�����A�е�ʵ������___��
��5����A�л��Һ������ˮ�����л�ɫҺ�������ԭ�����屽�л���___ (�ѧʽ)����γ�ȥ�������������Լ���___����Ӧ����Ϊ___��
��6��B�Թ�����������������Һ����ʵ�������ǣ�___��������������Һ��Ŀ����Ϊ�˼���___���ѧʽ�������ɣ��Ӷ�֤���÷�ӦΪ___���Ӧ���ͣ���
���𰸡�![]() ����Br2 ������ �к���ɫ������� Br2 NaOH ��Һ ����dz��ɫ���� HBr ȡ����Ӧ
����Br2 ������ �к���ɫ������� Br2 NaOH ��Һ ����dz��ɫ���� HBr ȡ����Ӧ
��������
��1�����廯�������������£���ͱ�����ȡ����Ӧ�����屽��
��2����ͱ��ӷ����������ɵ�HBr�к�����ͱ������ܺ���������Ӧ���ɵ���ɫ��������HBr������ɸ��ţ����塢�����������Ȼ�̼��
��3�������巴Ӧ�����廯������������ã�
��4����Ӧ���ȣ���ӷ����к���ɫ���������
��5��Br2��NaOH��Ӧ���屽��֮�ֲ㣬�ٷ�Һ��
��6�����廯�������������£���ͱ�����ȡ����Ӧ�����屽���廯�⣬������������Һ���м��顣
��1��ʵ�������屽������Һ���뱽���廯���Ĵ��·�Ӧ�����屽���廯�⣬��Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��2����ͱ��ӷ����������ɵ�HBr�к�����ͱ������ܺ���������Ӧ���ɵ���ɫ��������HBr������ɸ��ţ����塢�����������Ȼ�̼������˫��U����ʢ�ŵ��Լ���CCl4������������������������ֹ����HBr�ļ��飻
��3��A����˿�����ã������巴Ӧ�����廯������������ã�
��4����Һ©����Һ�����A�У���Ӧ���ȣ���ӷ����к���ɫ���������
��5����A�л��Һ������ˮ�����л�ɫҺ�������ԭ�����屽�л���Br2����γ�ȥ�����ʣ�����ǿ�������䷴Ӧ����ȥ���������Լ���NaOH����Ӧ���屽��֮�ֲ㣬��Ӧ����Ϊ��Һ��
��6��B�Թ�����������������Һ�����е��廯����ˮ��Һ�е���������������������ӷ�Ӧ�����廯����������ʵ�������ǣ�����dz��ɫ������������������Һ��Ŀ����Ϊ�˼���HBr�����ɣ��Ӷ�֤���÷�ӦΪȡ����Ӧ��

����Ŀ�������ڼ��������¿ɻ�ԭ����ͭ����������ˮ�����⣬����̼�������ij��ѧС��������ͼװ��̽���䷴Ӧ���
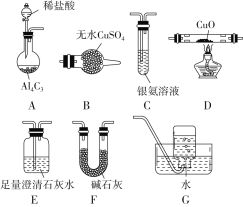
���������ϣ�
��CO����������Һ��Ӧ��CO��2Ag(NH3)2����2OH��=2Ag����2NH4����CO32����2NH3��
��Cu2OΪ��ɫ������Ag����Ӧ��������Ӧ��Cu2O��2H��=Cu2����Cu��H2O��
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ__________________________��
��2�������������װ�ô����ҵ�����˳��ΪA��_____________________��
��3��ʵ���еμ�ϡ����IJ�����_________________________��
��4����֪��������к���CO����װ��C�п��ܹ۲쵽��������___________________________��װ��F������Ϊ____________________��
��5������Ӧ������װ��D���Թ��й���ȫ����Ϊ��ɫ��
�����ʵ��֤����ɫ�����к���Cu2O��______��
����֤����ɫ�������Ƿ���Cu����ͬѧ�������ʵ�飺��������ɫ�����м���������0.1 mol/L AgNO3��Һ��������Һ�������ݴ��жϺ�ɫ�����к���Cu����ͬѧ��Ϊ�÷�������������֤����ͬѧ�Ľ��ۣ�����Ҫ���ӶԱ�ʵ�飬��ɱ������ݡ�
ʵ�鲽��(��Ҫ��д������IJ�������) | Ԥ����������� |
________________________ | ���۲쵽��Һ����������֤����ɫ�����к���Cu |