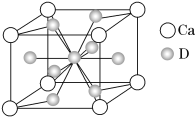
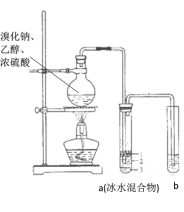
题目内容
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )

A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
C.原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种
D.d点溶液中含有的溶质只有Na2SO4
【答案】A
【解析】
加入NaOH溶液,根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,沉淀部分溶解,则溶液中一定含有Al3+,根据离子共存可知,溶液中一定不存在CO32-;
当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+;
根据溶液电中性可知,溶液中还必须存在阴离子,所以一定还有NO3-;
从ab和cd耗碱体积比值可知,若为Fe3+,则Fe3+和Al3+的物质的量之比为1:1,刚好与纵坐标数据吻合;若为Mg2+,Mg2+和Al3+的物质的量之比为1.5:1,不能与纵坐标数据吻合,所以溶液中一定含有Fe3+,一定不含Mg2+.
A.根据分析可知,原溶液中含有的Fe3+和Al3+,且二者的物质的量相等,即其物质的量之比为1:1,故A正确;
B.溶液中不存在镁离子,ab段发生的反应为:Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,故B错误;
C.溶液中含有的阳离子必定有Fe3+、H+、NH4+、Al3+,一定不存在Mg2+,故C错误;
D.在d点溶液中含有的溶质并不只有Na2SO4,还含有NaAlO2,故D错误;
故选:A。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】丙烯等不饱和烃在有机化工领域有重要的用途,工业上常采用“丙烷脱氢法”制取丙烯,反应的原理为:C3H8(g)![]() C3H6(g)+H2(g) ΔH=+123kJ/mol
C3H6(g)+H2(g) ΔH=+123kJ/mol
回答下列问题:
(1)在石油工业中可通过___工艺获得丙烯等不饱和烃(填一种工艺的名称)。
(2)已知:
化学键 | C-H | C-C | C=C | H-H |
键能(kJ/mol) | 412 | 348 | a | 436 |
表中的a=___。
(3)工业上进行该反应时,常在丙烷中掺入稀有气体作为稀释剂,在体积可变的反应容器中,维持恒温,并使总压强恒定为0.1MPa,掺入稀有气体作为稀释剂的优点是___,试从平衡角度加以解释___。
(4)在某密闭容器中充入适量的丙烷,测得丙烷的转化率随温度和压强变化如图所示:
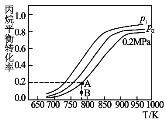
①压强p1___p2(填“>”、“<”或“=”)。
②图中A点平衡常数Kp=___(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留三位有效数字)。
③B点若达到A点所示的平衡状态则在建立平衡过程中v正___ v逆(填“>”、“<”或“=”)。
④写出一条提高丙烷平衡转化率的措施___。
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式___________。写出C原子的电子排布式___________
(2)四种元素中非金属性最强的元素是____,金属性最强的元素是_____,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为__________________________。