题目内容
【题目】下列有关离子方程式或离子共存的叙述正确的是
A. 将磁性氧化铁溶于氢碘酸: Fe3O4 + 8H+= 2Fe3++ Fe2+ + 4H2O
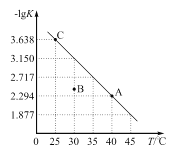
B. 常温下, 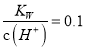 的溶液中:Na+、K+、AlO2-、HCO3-
的溶液中:Na+、K+、AlO2-、HCO3-
C. Na2S2O3溶液中加入稀硫酸:S2O32- + 2H+ = SO2↑ + S↓ + H2O
D. Na2S溶液中:SO![]() 、H+、Cl-、Cu2+
、H+、Cl-、Cu2+
【答案】C
【解析】A、将磁性氧化铁溶于氢碘酸,发生反应的离子方程式为: Fe3O4 + 8H++2I-= 2I2+ 3Fe2++ 4H2O,选项A错误;B、常温下, 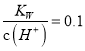 的溶液呈碱性,OH-与HCO3-反应生成和水而不能大量共存,选项B错误;C、Na2S2O3溶液中加入稀硫酸,发生反应的离子方程式为:S2O32- + 2H+ = SO2↑ + S↓ + H2O,选项C正确;D、Na2S溶液中:S2-会与H+反应生成硫化氢气体,与Cu2+反应生成硫化铜沉淀而不能大量共存,选项D错误。答案选C。
的溶液呈碱性,OH-与HCO3-反应生成和水而不能大量共存,选项B错误;C、Na2S2O3溶液中加入稀硫酸,发生反应的离子方程式为:S2O32- + 2H+ = SO2↑ + S↓ + H2O,选项C正确;D、Na2S溶液中:S2-会与H+反应生成硫化氢气体,与Cu2+反应生成硫化铜沉淀而不能大量共存,选项D错误。答案选C。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%