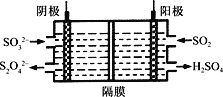
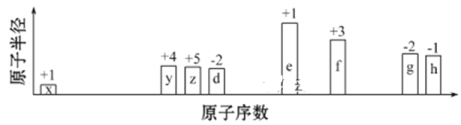
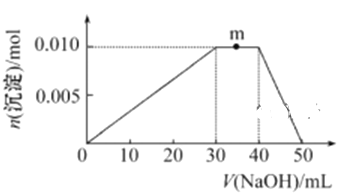
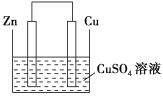
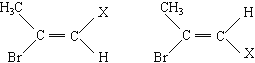题目内容
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:
(1)烃A的分子式为__________.
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则燃烧时消耗标准状况下的氧气____________L.
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为_____________.
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式有三种,它们分别为________、________、_____.
【答案】C6H12100.8![]() (CH3)3C﹣CH=CH2CH3C(CH3)=C(CH3)﹣CH3CH3CH(CH3)﹣C(CH3)=CH2.
(CH3)3C﹣CH=CH2CH3C(CH3)=C(CH3)﹣CH3CH3CH(CH3)﹣C(CH3)=CH2.
【解析】
(1)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol,说明1个烃分子中含有6个碳原子和12个氢原子,分子式为C6H12。(2) 若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,说明该烃的物质的量为0.5mol,根据方程式C6H12+9O2=6CO2+6H2O分析,消耗4.5mol氧气,标况下体积为22.4×4.5=100.8L; (3) 若烃A不能使溴水褪色,说明没有不饱和键,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,说明结构对称性很强,只有一种碳原子和一种氢原子,所以结构为 ![]() ; (4) 若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,结构可能为(CH3)3C﹣CH2CH3或(CH3)2CHCH(CH3)2,所以烃A可能有的结构简式有三种:(CH3)2C﹣CH=CH2、(CH3)2C=C(CH3)2 ,CH3CH(CH3)﹣C(CH3)=CH2。
; (4) 若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,结构可能为(CH3)3C﹣CH2CH3或(CH3)2CHCH(CH3)2,所以烃A可能有的结构简式有三种:(CH3)2C﹣CH=CH2、(CH3)2C=C(CH3)2 ,CH3CH(CH3)﹣C(CH3)=CH2。

 阅读快车系列答案
阅读快车系列答案