题目内容
15.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成H2的总量,可向盐酸中加入适量的( )| A. | CaCO3(固) | B. | NaCl溶液 | C. | KNO3溶液 | D. | CuSO4(固) |
分析 为了减缓反应速率且不影响生成H2的总量,可使溶液中H+浓度降低,但总量不变,以此解答该题.
解答 解:A.加入CaCO3固体,消耗H+,生成氢气的总量较少,故A错误;
B.加入NaCl溶液,H+浓度降低,但总量不变,可减缓反应速率且不影响生成H2的总量,故B正确;
C.加入KNO3溶液,生成NO气体,不生成氢气,故C错误;
D.加入CuSO4固体,置换出铜,形成原电池反应,反应速率加快,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于基本概念的综合考查和运用,难度大不,注意把握题目要求以及影响反应速率的因素,学习中要注意相关基础知识的学习和积累.

练习册系列答案
相关题目
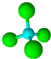
14. 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )| A. | 1molAl2H6中约含有4.8×1024个σ键 | |
| B. | 60gAl2H6中含铝原子约为1.2×1023个 | |
| C. | Al2H6可以燃烧,产物为氧化铝和水 | |
| D. | Al2H6在固态时所形成的晶体是离子晶体 |
6.下列晶体属于分子晶体的是( )
| A. | 石英 | B. | C60 | C. | NaCl | D. | 金属K |
4.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 常温常压下,17g NH3所含的原子数目为4NA | |
| C. | 铝与足量盐酸反应,生成2.24L H2时,转移的电子数为0.2NA | |
| D. | 0.1mol/L Na2CO3溶液中含有的Na+数目为0.2NA |
5.下列卤代烃能发生消去反应的是( )
| A. | CH3Br | B. | 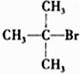 | C. | 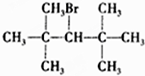 | D. | 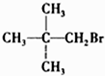 |
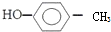
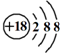
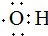
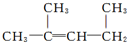 的名称:1,3-二甲基-2丁烯( )
的名称:1,3-二甲基-2丁烯( )