题目内容
3.25℃时,测得某溶液由H2O电离产生的H+浓度为1.0×10-13mol/L,则关于该溶液的判断正确的是( )| A. | 一定是碱的溶液,且pH=13 | |
| B. | 一定是酸的溶液,且pH=1 | |
| C. | 有可能是盐的溶液,由于发生了水解反应,使得pH=1或pH=13 | |
| D. | 酸、碱、盐的溶液均有可能 |
分析 测得某溶液由H2O电离产生的H+浓度为1.0×10-13mol/L,水的电离受到抑制,则溶液为酸溶液或碱溶液,据此分析.
解答 解:测得某溶液由H2O电离产生的H+浓度为1.0×10-13mol/L,水的电离受到抑制,则溶液为酸溶液或碱溶液,
A.水的电离受到抑制,则该溶液为酸溶液或碱溶液,故A错误;
B.水的电离受到抑制,则该溶液为酸溶液或碱溶液,故B错误;
C.盐溶液若发生了水解,则会促进水的电离,水的电离程度会增大,水电离的氢离子浓度大于1.0×10-7mol/L,故C错误;
D.酸、碱均会抑制水的电离,强酸的酸式盐能电离出大量的氢离子,在溶液中也会抑制水的电离,所以该溶液可能是酸、碱、盐的溶液,故D正确.
故选D.
点评 本题考查水的电离和盐的水解,注意水的离子积常数与溶液的温度有关,明确影响水的电离的因素即可解答,难度不大.

练习册系列答案
相关题目
13.下列关于电解质溶液的叙述不正确的是( )
| A. | 25℃,将pH=11的氢氧化钠溶液稀释100倍后,溶液的pH=13 | |
| B. | pH=1的盐酸和醋酸溶液,分别加水稀释100倍后醋酸溶液pH更小 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,醋酸溶液消耗NaOH的物质的量更多 | |
| D. | pH=1的洁厕剂中c(H+)是pH=6的洗发液中c(H+)的105倍 |
14.氯水的pH( )
| A. | 小于7 | B. | 等于7 | C. | 大于7 |
11.下列各图象中指定时刻(t1)或指定温度(T1)时,表示可逆反应以达到平衡的是( )
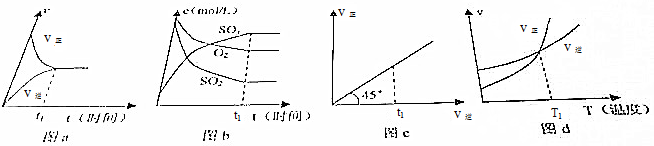

| A. | 只有图a和图b | B. | 只有图a和图d | ||
| C. | 只有图a、图b和图d | D. | 图a、图b、图c和图d都是 |
4.下列相关反应 的离子方程式或化学方程式书写正确的是( )
| A. | CuSO4溶液呈酸性的原因:Cu2++2H2O═Cu(OH)2↓+2H+ | |
| B. | 向NH4HCO3溶液中加过量石灰水并加热:${NH}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Fe(OH)2溶于氨碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 氧化亚铜和稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O |
11.下列有关物质的分类或有关物质的说法正确的是( )
| A. | 一氧化碳、二氧化氮、一氧化氮都是大气污染物,在空气中都能稳定存在 | |
| B. | 高锰酸钾或重铬酸钾不能与草酸或铝粉存放在同一个药品柜里 | |
| C. | 二氧化硅、五氧化二磷都是酸性氧化物,都与水反应生成相应的含氧酸 | |
| D. | 氧化钠、氢氧化钠、都是含氧化合物,与水反应产物相同 |
8.如图为雾霾的主要成分示意图.下列说法错误的是( )
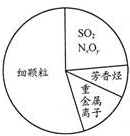

| A. | SO2、NxOy都属于酸性氧化物 | |
| B. | 碳氢化合物可引起光化学烟雾 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
9.胶体区别于其它分散系的本质特征是( )
| A. | 胶体的分散质能透过滤纸 | |
| B. | 胶体能产生丁达尔现象 | |
| C. | 胶体是纯净物,其它分散系是混合物 | |
| D. | 胶体的分散质粒子直径在10-7~10-9m之间 |
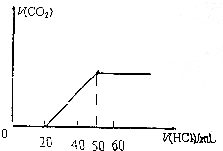 Ⅰ.取10mL密度1.20g/cm3、质量分数36.5%的y盐酸,加水稀释至300mL,则稀释后盐酸的物质的量浓度是0.4mol/L;
Ⅰ.取10mL密度1.20g/cm3、质量分数36.5%的y盐酸,加水稀释至300mL,则稀释后盐酸的物质的量浓度是0.4mol/L;