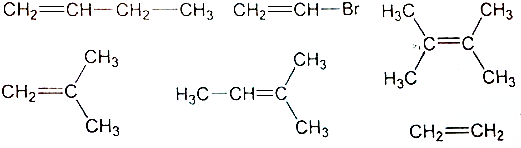
题目内容
5.巴豆酸的结构简式为CH3CH=CH-COOH,现有①氯化氢、②溴水、③纯碱溶液、④酸性高锰酸钾溶液、⑤2-丁醇. 试根据其结构特点判断在一定条件下能与巴豆酸反应的物质的组合是( )| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
分析 CH3CH=CHCOOH中含碳碳双键、-COOH,结合烯烃、羧酸的性质来解答.
解答 解:巴豆酸分子中含有碳碳双键和羧基,所以巴豆酸具有烯烃和羧酸的性质,与①氯化氢、②溴水发生加成反应,与④酸化的高锰酸钾溶液发生氧化反应,表现碳碳双键的性质;与③纯碱溶液发生复分解反应,与⑤2-丁醇发生酯化反应,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸性质的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列所述事实与化学(离子)方程式不相符的是( )
| A. | 能说明盐酸是强酸:2HCl+CaCO3═CaCl2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
13.下列对碱金属性质的叙述中正确的是( )
| A. | 都是银白色的柔软金属(除铯外),密度都小于水 | |
| B. | 单质的熔、沸点随原子序数的增加而升高 | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 氧化能力最强的是铯原子 |
10.温度不变恒容的容器中0.1mol•L-1H2进行反应H2?2H,若某段时间内H2浓度由0.06mol•L-1降到0.036mol•L-1所需的反应时间为12s,则反应起始时H2浓度由0.1mol•L-1降到0.06mol•L-1需的时间为( )
| A. | 等于24s | B. | 等于20s | C. | 大于20s | D. | 小于20s |
17.把VL含有MgSO4和K2SO4的混合溶液分成两份,一份加入a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁.则原混合溶液中钾离子的浓度为( )mol/L.
| A. | 2b-$\frac{a}{v}$ | B. | 2a-$\frac{b}{v}$ | C. | $\frac{2(2b-a)}{v}$ | D. | $\frac{2(2a-b)}{v}$ |
15.下列有关电化学的叙述正确的是( )
| A. | 生铁中含碳,抗腐蚀能力比纯铁强 | |
| B. | 电解饱和食盐水制烧碱,可用铁作阳极 | |
| C. | 用锡焊接的铁器,焊接处易生锈 | |
| D. | 在铁器上镀铜时,镀件为阳极,铜盐为电镀液 |