题目内容
8.在N2+3H2 ?高温高压催化剂2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用H2表示的平均反应速率为0.45mol/(L•s).则反应所经过的时间是( )| A. | 2s | B. | 2 min | C. | 3s | D. | 3 min |
分析 利用速率之比等于化学计量数之比,根据H2表示的平均反应速率v(H2)计算速率v(NH3),再根据速率定义计算反应时间.
解答 解:由于v(H2)=0.45mol/(L•s),速率之比等于化学计量数之比,所以v(NH3)=23(H2)=23×0.45mol/(L•s)=0.3mol/(L•s),所以反应所经历的时间为0.6mol0.3mol/(L•s)=2s.故选A.
点评 本题考查化学反应速率,难度较小,注意基础知识的积累与掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下述实验方案能达到实验目的是( )
| A. |  验证铁钉发生吸氧腐蚀 | |
| B. | 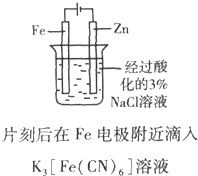 证明Fe电极被保护 | |
| C. | 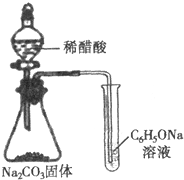 酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 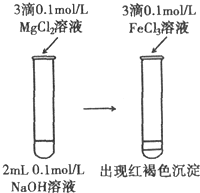 溶解度:Mg(OH)2>Fe(OH)3 |
16.已知某有机物9.2g与足量氧气在密闭容器中完全燃烧后,将反应生成的气体依次通过浓硫酸和碱石灰.浓硫酸增重10.8g,碱石灰增重17.6g,该有机物的化学式是( )
| A. | CH4O | B. | C2H4O | C. | C2H6O | D. | C2H6O2 |
20.下列各组元素中,位于同一周期的是( )
| A. | 硅、硫、氯 | B. | 锂、钠、钾 | C. | 氟、氯、溴 | D. | 碳、氧、铝 |
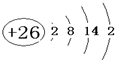 .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和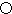 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.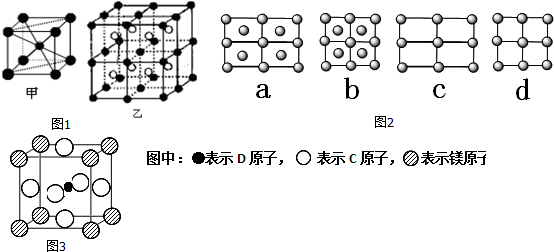
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.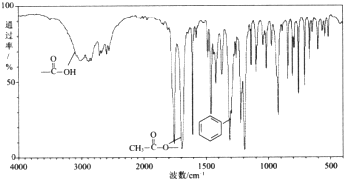
 ,X在一定条件下能发生的反应是acd(选填字母);
,X在一定条件下能发生的反应是acd(选填字母); )能与化合物Y在一定条件发生取代反应生成X与乙酸,该反应的化学方程式是
)能与化合物Y在一定条件发生取代反应生成X与乙酸,该反应的化学方程式是 ;
; ②苯环上的一溴代物只有两种
②苯环上的一溴代物只有两种 :
: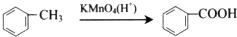
 .
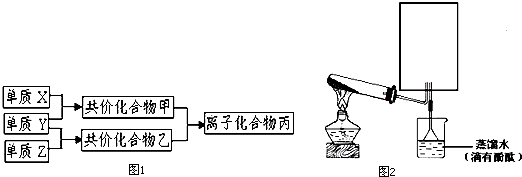
.
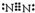 .
.