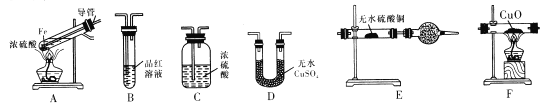
题目内容
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
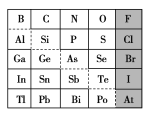
(1)元素Ga在元素周期表中的位置为:第________周期第________族。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物为________。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是________元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4________(填“>”“<”或“=”)H2SeO4。
③氢化物的还原性:H2O________(填“>”“<”或“=”)H2S。
④原子半径比较:N________(填“>”“<”或“=”)Si。
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱___________________ (可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液)
【答案】4 ⅢA +4 HClO4 Bi2O5 F < < < CaCO3固体,盐酸,饱和NaHCO3溶液, Na2SiO3溶液
【解析】
根据各元素在周期表中的位置及元素周期律进行判断。
(1)B元素为第2周期第ⅢA族,和它同主族的相差两个电子层的是Ga元素,在第4周期第ⅢA族;
(2)碳、锡同为第IVA族,其最外层均有4个电子,所以Sn的最高价为+4;Cl最外层有7个电子,其最高价为+7价,最高价氧化物对应的水化物为HClO4;Bi的最外层有五个电子,其最高价氧化物为Bi2O5;
(3)①阴影部分为卤族元素。同主族元素从下往上,元素的非金属性逐渐增强,故卤族元素中F的非金属性最强,其对应的氢化物热稳定性最高;
②同周期元素,随着原子序数的递增,元素的非金属性越强,其最高价氧化物的水化物酸性也越强,所以H3AsO4酸性小于H2SeO4;
③氧的非金属性强于硫,所以H2O的还原性弱于H2S;
④由于原子半径Si>P,P>N,所以原子半径Si>N;
(4) 比较C、Si的非金属性强弱,可以通过比较H2CO3和H2SiO3的酸性强弱来实现,而比较两种酸的强弱可利用“复分解反应中强酸制弱酸的基本原理”。 选用稀盐酸与碳酸钙反应制取CO2,不选用稀硫酸与碳酸钙反应来生成二氧化碳,是因为会生成微溶的硫酸钙,覆盖在碳酸钙表面,阻止反应进一步进行。选用饱和NaHCO3溶液,以除去挥发出的HCl气体,不选用饱和Na2CO3,因为发生反应消耗了CO2:Na2CO3+CO2+H2O=2NaHCO3;将生成的CO2气体通过饱和碳酸氢钠溶液后再将气体通入Na2SiO3溶液。依据生成白色胶状沉淀,得出酸性H2CO3>H2SiO3,所以据此可判断出非金属性C>Si。本实验选择的试剂有:CaCO3固体,盐酸,饱和NaHCO3溶液, Na2SiO3溶液。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案