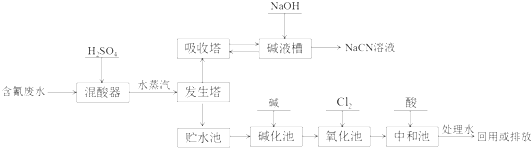
题目内容
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合物的代数和为6;R和Q可形原子数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应.请回答下列问题:
(1)T元素在期表中的位置是________;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为________(写出其中一种物质的名称).
(2)X、Z、Q三种元素的原子半径由小到大顺序为________(填元素符号).
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为________.
(4)下列可以判断R和T金属性强弱的是________(填序号).
a.单质的熔点R比T低 b.单质与酸反应时,失电子数R比T少
c.单质与水反应R比T剧烈 d.最高价氧化物的水化物的碱性R比T强
(5)某同学用Q、R两元素的单质反应生成固体物质R2Q2,R2Q2属于离子化合物,且能与化合物X2Q反应生成Q的单质.R2Q2的电子式为________;R2Q2与X2Q反应的化学方程式为________。
【答案】 第三周期ⅢA族 碳酸氢钠、醋酸钠、四羟基合铝酸钠等 H<O<C Al(OH)3+3H+=Al3++3H2O cd ![]() 2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
【解析】全部元素中X的原子半径最小,X为H;Z的内层电子数是最外层电子数的一半,则Z为C;X与R的最外层电子数相等且R的原子序数大于Z的原子序数,所以R为Na;U的最高化合价和最低化合物的代数和为6,则U为Cl;R和Q可形原子数之比为1:1和2:1的两种化合物,所以Q为O;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应,则其中有一种化合物显两性,,故T为Al。故X、Z、Q、R、T、U分别为:H、C、O、Na、Al、Cl。
(1)Al处于周期表的第三周期ⅢA族;四种元素形成的既含有离子键又含有共价键的化合物有:碳酸氢钠、醋酸钠、四羟基合铝酸钠等。
(2)H、C、O的原子半径由小到大的顺序为:H<O<C。
(3)Al和Cl的最高价氧化物的水化物分别为Al(OH)3和HClO4,两者反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O。
(4)Na和水反应比Al和水反应剧烈、NaOH的碱性大于Al(OH)3的碱性均可以说明Na的金属性大于Al的金属性,单质的熔点Na比Al低、单质与酸反应时,失电子数Na比Al少均不能说明Na的金属性大于Al的金属性,故答案选cd。
(5)R2Q2的化学式为Na2O2,电子式为![]() ,Na2O2与H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑。
,Na2O2与H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑。