题目内容
13.下列工业产品的生产设计中原子利用率没有达到100%的是( )| A. | 合成甲醇:CO+2H2$→_{加热加压}^{催化剂}$CH3OH | |
| B. | 合成乙醛:2CH2=CH2+O2$→_{加热加压}^{催化剂}$2CH3CHO | |
| C. | 合成全降解聚碳酸酯塑料: +nCO2$\stackrel{催化剂}{→}$ +nCO2$\stackrel{催化剂}{→}$ | |
| D. | 合成有机玻璃单体-甲基丙烯酸甲酯:第一步: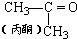 +HCN→(CH3)2C(OH)CN +HCN→(CH3)2C(OH)CN第二步:(CH3)2C(OH)CN+CH3OH+H2SO4→  +NH4HSO4 +NH4HSO4 |
分析 反应物中所有原子都转化为生成物,没有副产物的反应的原子经济利用率最高为100%,据此解答.
解答 解:A.一氧化碳与氢气反应生成甲醇,没有副产物生成,原子经济利用率100%,故A不选;
B.乙烯与氧气完全转化为乙醛,没有副产物生成,原子经济利用率100%,故B不选;
C. 和水反应全部转化为聚碳酸酯塑料,没有副产物生成,原子经济利用率100%,故C不选;
和水反应全部转化为聚碳酸酯塑料,没有副产物生成,原子经济利用率100%,故C不选;
D.反应除了生成目标产物外,还生成副产物NH4HSO4,原子经济利用率不是100%,故D选;
故选:D.
点评 本题考查了原子经济利用率,明确原子经济利用率的含义是解题关键,注意原子经济利用率100%的反应,不能有副产物生成.

练习册系列答案
相关题目
3.设阿伏加德罗常数为NA,下列说法正确的是(Mg-24)( )
| A. | 2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA | |
| B. | 常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA | |
| C. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| D. | 18g H2O含有的电子数10NA |
4.中国科学家许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子.一个该分子含l134个碳原子和l146个氢原子.下列有关此分子的说法中错误的是( )
| A. | 属于烃类化合物 | B. | 常温下为固态 | ||
| C. | 易燃烧 | D. | 具有类似金刚石的硬度 |
1.既含有离子键又含有共价键的物质是( )
| A. | O2 | B. | CaO | C. | C2H6 | D. | KOH |
8.下列属于加成反应的是( )
| A. | CH2=CH2+HCl→CH3CH2Cl | B. | CH3CH3+Cl2→CH3CH2Cl+HCl | ||
| C. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | D. |  +3NaOH$\stackrel{△}{→}$3C17H35COONa+ +3NaOH$\stackrel{△}{→}$3C17H35COONa+ |
18.据统计,陕西省的机动车保有量每年以15%至20%的速度增长,汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.4mol,则下列判断正确的是( )
| A. | 生成22.4LN2(标准状况) | B. | 有0.25molKNO3被氧化 | ||
| C. | 转移电子的物质的量为0.5mol | D. | 被氧化的N原子的物质的量为3mol |
5.下列实验装置图正确的是( )
| A. |  实验室制备并检验乙烯 实验室制备并检验乙烯 | B. |  石油分馏 石油分馏 | ||
| C. |  验证醋酸、碳酸、苯酚酸性强弱 验证醋酸、碳酸、苯酚酸性强弱 | D. |  实验室制乙炔 实验室制乙炔 |
15.与KOH化学键类型相同的物质是( )
| A. | HClO | B. | MgCl2 | C. | H2O2 | D. | Na2O2 |
 .
. ,所含化学键类型为离子键、共价键.
,所含化学键类型为离子键、共价键.