题目内容
18.据统计,陕西省的机动车保有量每年以15%至20%的速度增长,汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.4mol,则下列判断正确的是( )| A. | 生成22.4LN2(标准状况) | B. | 有0.25molKNO3被氧化 | ||
| C. | 转移电子的物质的量为0.5mol | D. | 被氧化的N原子的物质的量为3mol |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑中,只有N元素化合价发生变化,N元素的化合价分别由负价升高为0、由+5价降低为0,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,若氧化产物比还原产物多1.4mol,则生成1.6molN2,转移电子的物质的量为1mol,被氧化的N原子的物质的量为3mol,以此解答该题.
解答 解:10NaN3+2KNO3═K2O+5Na2O+16N2↑中,只有N元素化合价发生变化,N元素的化合价分别由负价升高为0、由+5价降低为0,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,若氧化产物比还原产物多1.4mol,则生成1.6molN2,转移电子的物质的量为1mol,被氧化的N原子的物质的量为3mol,
A.生成1.6molN2,体积为1.6mol×22.4L/mol=35.64L,故A错误;
B.由以上分析可知有0.2molKNO3被还原,故B错误;
C.转移电子的物质的量为1mol,故C错误;
D.参加反应的NaN3物质的量为1mol,则被氧化的N原子的物质的量为3mol,故D正确.
故选D.
点评 本题考查了氧化还原反应,根据元素化合价变化结合各个物理量之间的关系式分析解答,注意氮化钠中N元素化合价,该反应的氧化产物和还原产物都是氮气,知道氧化产物和还原产物的物质的量之比,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8. 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4 (s)+2H2O (l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |
9.苯环结构中不存在C-C与C-C的简单交替结构,可以作为证据的事实是( )
①苯不能使酸性KMn4溶液褪色 ②苯不能使溴水因化学反应而褪色 ③经实验测定,邻二甲苯只有一种结构
④苯能在加热和催化剂条件下氢化成环己烷 ⑤苯中相邻碳原子间的距离都相等.
①苯不能使酸性KMn4溶液褪色 ②苯不能使溴水因化学反应而褪色 ③经实验测定,邻二甲苯只有一种结构
④苯能在加热和催化剂条件下氢化成环己烷 ⑤苯中相邻碳原子间的距离都相等.
| A. | 只有①② | B. | 只有④⑤ | C. | 只有①②⑤ | D. | 只有①②③⑤ |
6.能源是人类可持续发展面临的重要问题,某科学家设计的UT-3热化学循环如图所示:

该过程最终制得的能源气体是( )

该过程最终制得的能源气体是( )
| A. | H2 | B. | O2 | C. | HBr | D. | Br2 |
13.下列工业产品的生产设计中原子利用率没有达到100%的是( )
| A. | 合成甲醇:CO+2H2$→_{加热加压}^{催化剂}$CH3OH | |
| B. | 合成乙醛:2CH2=CH2+O2$→_{加热加压}^{催化剂}$2CH3CHO | |
| C. | 合成全降解聚碳酸酯塑料: +nCO2$\stackrel{催化剂}{→}$ +nCO2$\stackrel{催化剂}{→}$ | |
| D. | 合成有机玻璃单体-甲基丙烯酸甲酯:第一步: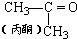 +HCN→(CH3)2C(OH)CN +HCN→(CH3)2C(OH)CN第二步:(CH3)2C(OH)CN+CH3OH+H2SO4→  +NH4HSO4 +NH4HSO4 |
3.在由4种基团-CH3、-OH、-C6H5、-COOH两两组成的物质中,在通常情况下能与NaOH反应的有机物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
3.下列各组反应,实质都是取代反应的是( )
| A. | 酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸在140℃时加热 | |
| B. | 苯硝化,苯和氢气反应,皂化反应 | |
| C. | 淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 | |
| D. | 纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
20.雾霾的化学成分较为复杂,包含有下列物质,其中属于有机物的是( )
| A. | 臭氧 | B. | 一氧化碳 | C. | 氮氧化物 | D. | 碳氢化合物 |
1.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,22.4 L乙烯中含C-H键的数目为4NA | |
| B. | 1molFe与足量盐酸反应转移电子数为3NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为0.1NA | |
| D. | 向1L 1 mol•L-1氯化铝溶液中加入足量的氨水,生成AlO2-的个数为NA |