题目内容
3.设阿伏加德罗常数为NA,下列说法正确的是(Mg-24)( )| A. | 2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA | |
| B. | 常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA | |
| C. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| D. | 18g H2O含有的电子数10NA |
分析 A.镁为2价金属,0.1mol镁完全反应失去0.2mol电子;
B.1mol氯化镁中含有2mol氯离子;
C.常温常压下,Vm≠22.4L/mol;
D.水分子中含有10个电子,18g水的物质的量为1mol,含有10mol电子.
解答 解:A.2.4g镁的物质的量为0.1mol,0.1mol镁与足量盐酸反应生成0.1mol氢气,失去0.2mol电子,反应失去电子数为0.2NA,故A正确;
B.1L 0.2mol/L MgCl2溶液中含有0.2mol氯化镁,0.2mol氯化镁中含有0.4mol氯离子,含Cl-数为0.4NA,故B错误;
C.常温常压下,Vm≠22.4L/mol,无法计算氧气的物质的量,故C错误;
D.18g水的物质的量为1mol,1mol水中含有10mol电子,含有的电子数10NA,故D正确;
故选:AD.
点评 本题考查查阿伏加德罗常数的有关计算和判断,明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系即可解答,题目难度不大.

练习册系列答案
相关题目
13.下列除杂方法(括号内为杂质)和操作正确的是( )
| A. | 乙醇(水):加新制的生石灰,过滤 | |
| B. | 溴苯(苯):加水,振荡静置后分液 | |
| C. | 乙烷(乙烯):通过溴水溶液,洗气 | |
| D. | 乙酸乙酯(乙酸):加NaOH溶液,振荡静置后蒸馏 |
14.氢氧燃料电池是将H2和O2通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式分别为:2H2+4OH--4e-═4H2O和O2+2H2O+4e-═4OH-,下列不正确的是( )
| A. | 氢氧燃料电池属于环境友好电池 | |
| B. | 通O2的极是正极,通入H2的极是负极 | |
| C. | 工作一段时间后KOH溶液的溶质质量分数增大 | |
| D. | 工作时溶液中的OH-向负极作定向移动 |
11.下列变化中,需要与适当还原剂反应才能完成的是( )
| A. | CuO→Cu | B. | KCl→AgCl | C. | Fe→FeCl3 | D. | NaHCO3→CO2 |
18.在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是( )
| A. | 正、逆反应速率都等于零 | B. | HI、H2、I2的浓度相等 | ||
| C. | HI、H2、I2在容器中共存 | D. | HI、H2、I2的浓度均不再变化 |
8. 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4 (s)+2H2O (l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |
12. 将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
 将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )| A. | 试管中气体的黄绿色逐渐变浅,水面上升 | |
| B. | 生成物只有三氯甲烷和氯化氢在标准状况下是气体 | |
| C. | 试管内壁有油状液滴形成 | |
| D. | 试管内有少量白雾 |
13.下列工业产品的生产设计中原子利用率没有达到100%的是( )
| A. | 合成甲醇:CO+2H2$→_{加热加压}^{催化剂}$CH3OH | |
| B. | 合成乙醛:2CH2=CH2+O2$→_{加热加压}^{催化剂}$2CH3CHO | |
| C. | 合成全降解聚碳酸酯塑料: +nCO2$\stackrel{催化剂}{→}$ +nCO2$\stackrel{催化剂}{→}$ | |
| D. | 合成有机玻璃单体-甲基丙烯酸甲酯:第一步: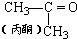 +HCN→(CH3)2C(OH)CN +HCN→(CH3)2C(OH)CN第二步:(CH3)2C(OH)CN+CH3OH+H2SO4→  +NH4HSO4 +NH4HSO4 |

 .
. CH3COOCH2CH3+H2O,反应类型酯化反应或取代反应.
CH3COOCH2CH3+H2O,反应类型酯化反应或取代反应.