题目内容
【题目】化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:

(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g)![]() CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
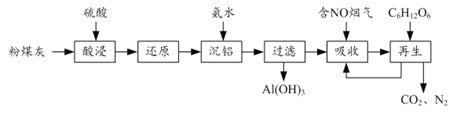
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
【答案】 减小 B < Al3++3H2O![]() Al(OH)3(胶体)+3H+ pH=6
Al(OH)3(胶体)+3H+ pH=6
【解析】(1)由图2分析可知,温度升高,甲醇的物质的量降低,说明平衡逆向移动,由此反应K的表示式可知,升高温度, K值减小。(2)pH=2的盐酸和醋酸溶液分别与适量的Zn粒反应,pH由2变化4所需要时间短的是盐酸,起始时两种的氢离子浓度相同,但醋酸分子不断电离出氢离子,所以,B线代表的是醋酸,因两酸的体积相同,醋酸的浓度大于盐酸,所以消耗的锌的质量也多,即m2> m1。(3)明矾在水中电离产生铝离子,铝离子水解产生具有吸附能力的氢氧化铝胶体,其原理是Al3++3H2O![]() Al(OH)3(胶体)+3H+;(4)Ksp[Cr(OH)3]=c(Cr3+)×c3(OH—)= 6.0×10-7mol/L× c3(OH—) =6.0×10-31,c(OH—)= 1.0×10-8mol/L,pH=6。
Al(OH)3(胶体)+3H+;(4)Ksp[Cr(OH)3]=c(Cr3+)×c3(OH—)= 6.0×10-7mol/L× c3(OH—) =6.0×10-31,c(OH—)= 1.0×10-8mol/L,pH=6。

 名校课堂系列答案
名校课堂系列答案