题目内容
【题目】常温时,用![]() 滴定
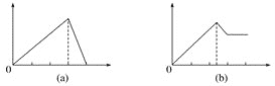
滴定![]() 某一元酸HX,滴定过程中pH变化曲线如图所示。
某一元酸HX,滴定过程中pH变化曲线如图所示。

下列说法正确的是
A. HX溶液显酸性的原因是![]()
B. 点a,![]()
C. 点b,![]() 与
与![]() 恰好完全反应
恰好完全反应
D. 点c,![]()
【答案】D
【解析】
根据滴定曲线(特殊点)的含义,分析电解质强弱、电离与水解的主次关系,并运用物料守恒关系解答。
A项:滴入![]() 溶液前,0.10mol/LHX溶液pH接近4,则HX为弱酸,电离方程式为HX
溶液前,0.10mol/LHX溶液pH接近4,则HX为弱酸,电离方程式为HX![]() H++X-,A项错误;
H++X-,A项错误;
B项:点a溶液中生成1.5mmolNaX、剩余1.0mmolHX。因溶液呈酸性,HX电离程度大于X-的水解程度,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),B项错误;
C项:当![]() 与
与![]() 恰好完全反应时生成NaX,因X的水解,溶液pH应大于7。点b的pH=7,必有HX剩余,C项错误;
恰好完全反应时生成NaX,因X的水解,溶液pH应大于7。点b的pH=7,必有HX剩余,C项错误;
D项:据物料守恒,曲线上任何一点都有n(X-)+n(HX)=25mL×0.10mol·L-1,点c溶液总体积约50mL,则![]() ,D项正确。
,D项正确。
本题选D。

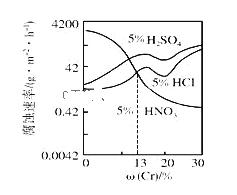
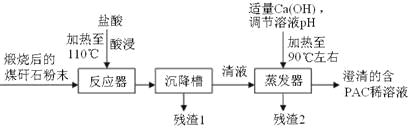
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为Cu、
外,还含有少量稀贵金属,主要物质为Cu、![]() 和
和![]() 。某铜沉淀渣的主要元素质量分数如下:
。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数 |
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
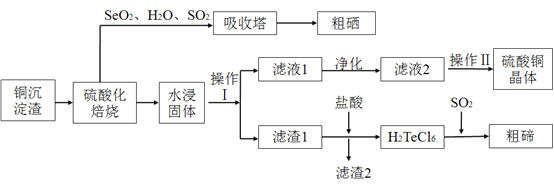
![]() 经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:
经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:![]() ____
____![]()
![]()
![]() ____
____![]() ____
____![]() ____
____![]()
![]() 与吸收塔中的
与吸收塔中的![]() 反应生成亚硒酸。焙烧产生的
反应生成亚硒酸。焙烧产生的![]() 气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
![]() 沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
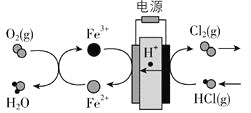
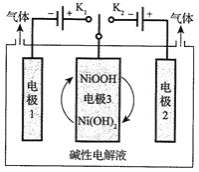
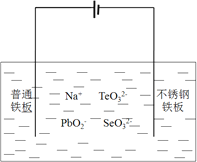
![]() 目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
【题目】在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 ![]() 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应:![]()
![]() ,一段时间后达到平衡。反应过程中测定的数据如下表:
,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前 ![]() 的平均速率
的平均速率 ![]()
B.该温度下此反应的平衡常数 ![]()
C.其他条件不变,再充入 ![]() Z ,平衡时 X 的体积分数不变
Z ,平衡时 X 的体积分数不变
D.其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)