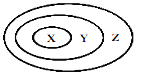
题目内容
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:

(1)在饱和食盐水中通入X和Y,则X______和Y_______(填物质名称),先通X后通Y的原因是_______________________。
(2)写出通入X和Y的化学反应方程式____________________________。
(3)操作Z包括________和________(填名称)。
(4)溶液B中含有的主要离子是_____________,为了得到化肥(NH4Cl),需要在溶液B中通入NH3、冷冻、加食盐,其中通入NH3的作用一_______________________________,作用二_______________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
① 称取样品ag,加水溶解;
② 加入足量的BaCl2溶液;
③ 过滤、_________、烘干、冷却、称量、烘干、冷却、_________,最终得到固体bg。样品中纯碱的质量分数为___________________(用含a、b的代数式表示)。
【答案】 氨气 二氧化碳 氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀 NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl 过滤 洗涤 Na+、HCO3-、NH4+、Cl- 将NaHCO3转化为Na2CO3 产生的NH4+有利于NH4Cl形成 洗涤 (再)称量 106 b/197a
【解析】(1)以食盐、氨和二氧化碳为原料来制取纯碱,氨气极易溶于水,先把氨气通入饱和食盐水中先形成碱性的盐溶液,然后通入二氧化碳气体,其水溶液显酸性,酸碱易发生中和反应,有利于碳酸氢钠沉淀,所以先通氨气,后通二氧化碳;正确答案:氨气 二氧化碳;氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀。
(2)食盐水中通入氨气和二氧化碳后发生反应生成碳酸氢钠和氯化铵,化学反应方程式:NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl;正确答案:NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl。
(3)分离固体和液体,进行过滤操作,再洗涤固体;所以操作Z包括过滤和洗涤;正确答案:过滤和洗涤。
4)经过过滤后,滤液中含有氯化铵及少量碳酸氢钠,因此溶液B中含有的主要离子是Na+、HCO3-、NH4+、Cl- ;为了得到化肥(NH4Cl),需要在溶液B中通入NH3、冷冻、加食盐,由于氨水显碱性,就会将NaHCO3转化为Na2CO3,反应产生的NH4+有利于NH4Cl形成;正确答案:Na+、HCO3-、NH4+、Cl- ;将NaHCO3转化为Na2CO3 ; 产生的NH4+有利于NH4Cl形成 。
(5)加入足量的![]() 溶液发生反应:
溶液发生反应:![]() ↓
↓![]() ,
,![]() ,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,再称量所得固体,最终得到固体
,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,再称量所得固体,最终得到固体![]() 为
为![]() ,根据碳守恒,纯碱的质量分数
,根据碳守恒,纯碱的质量分数![]() ;正确答案:洗涤;称量;
;正确答案:洗涤;称量;![]() 。
。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
(1)用催化技术将汽车尾气中的NO和CO转变成CO2和N2,反应原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
某温度下测得该反应在不同时间的CO浓度如下表:
时间(s) 浓度 ×10-3(molL-1) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
该反应平衡常数K的表达式____________________;温度升高,K值___________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=_______________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_________。
(2)工业合成氨的反应温度选择500℃左右的主要原因是______________________。
(3)在固定容积的密闭容器中,加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是__________________________________________________。
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液呈现酸性的原因________________________________(用离子方程式表示);在通入NH3的过程中溶液的导电能力______(选填“变大”、“变小”、“几乎不变”)。