题目内容
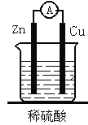
【题目】(19分)Ⅰ.实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4 各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水.
(1)应用托盘天平称量NaCl g,应用10mL量筒量取H2SO4 mL;
(2)配制两种溶液时都需要的仪器是 ;
(3)稀释浓H2SO4时应注意 ;
(4)在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)
A、在烧杯中溶解溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F、容量瓶刚用蒸馏水洗净,没有烘干
G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
H、容量瓶加水定容时俯视刻度线
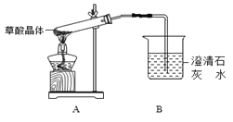
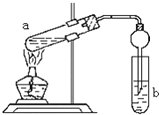
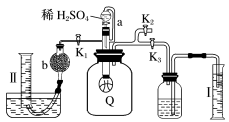
Ⅱ.为了测定已部分变质的过氧化钠样品的纯度(质量百分含量),设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中。按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。
请回答下列问题:
(1)Q内发生反应生成________种气体,其中的反应有________个为氧化还原反应。
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”),打开______(填“K1”、“K2”或“K3”)。
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是 。
(4)b中装的固体试剂是__________,需缓缓打开K1的原因为 。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是 (用含x、y的式子表示,上述体积均已折算成标准状况)。
【答案】
Ⅰ.(8分)(1)5.9 5.4 mL;
(2)烧杯、玻璃棒、500ml容量瓶、胶头滴管;
(3将浓硫酸沿烧杯内壁注入水中,边加边用玻璃棒搅拌;
(4) ABCE
Ⅱ.(11分)(1)2 1;
(2)K1、K2 K3;
(3)气球Q慢慢变小,气体进入量筒Ⅱ中
(4)碱石灰(其他合理答案也可以);控制气体的流速,使CO2被充分吸收
(5)![]() ×100%
×100%
【解析】
试题分析:Ⅰ.(1)配制480mL0.2mol/L的NaCl溶液,应选择500mL容量瓶,需要溶质的质量m=0.2mol/L×58.5g/mol×0.5L=5.9g;98%的浓H2SO4(密度为1.84g/cm3)的物质的量浓度C=![]() =18.4mol/L,配制480mL0.2mol/L 的稀H2SO4,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,解得V=0.0054L,即5.4mL;故答案为:5.9 5.4 mL;
=18.4mol/L,配制480mL0.2mol/L 的稀H2SO4,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,解得V=0.0054L,即5.4mL;故答案为:5.9 5.4 mL;
(2)配制NaCl溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,用到的仪器是:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制稀H2SO4的步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,用到的仪器是:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制两种溶液时都需要仪器:烧杯、玻璃棒、500ml容量瓶、胶头滴管;故答案为:烧杯、玻璃棒、500ml容量瓶、胶头滴管;
(3)由于浓硫酸密度大、溶于水放热,故稀释浓硫酸的方法:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;故答案为:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;
(4)A、在烧杯中溶解溶质搅拌时,溅出少量溶液,导致溶质的物质的量偏低,溶液浓度偏低,故A选;B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,导致溶质的物质的量偏低,溶液浓度偏低,故B选;C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,导致溶质的物质的量偏低,溶液浓度偏低,故C选;D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出,导致溶质的物质的量偏低,溶液浓度偏低,故D选;E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,溶液稀释,溶液浓度降低,故E选;F、容量瓶刚用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变,故F不选;G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中,量取的浓硫酸物质的量偏大,溶液浓度偏高,故不选;故选:ABCDE
Ⅱ.(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,前者的氧元素的化合价发生了变化,是氧化还原反应,后者元素的化合价未变,是非氧化还原反应,故答案为:2;1;
(2)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3,故答案为:K1、K2;K3;
(3)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小,故答案为:气球Q慢慢缩小;
(4)混合气体通过碱石灰吸收CO2,最后量筒Ⅱ中收集的是O2,故答案为:碱石灰;控制气体流速,使CO2充分吸收;
(5)2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑; Na2CO3 +H2SO4=Na2SO4+H2O+CO2↑,
![]() ×2
×2 ![]()
![]()
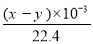
则过氧化钠的质量为:![]() ×2×78,碳酸钠的质量为:
×2×78,碳酸钠的质量为:![]() ×106,所以过氧化钠的纯度:
×106,所以过氧化钠的纯度:![]() =
=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。