题目内容
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2,K2=5.4×10﹣5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解为CO、CO2和H2O。回答下列问题:

(1)写出草酸晶体分解的化学方程式_________________________________。
(2)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。若实验过程中,B中澄清石灰水变浑浊,______(填“能”或“不能”)说明草酸晶体的分解产物中有CO2,原因是______。
(3)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A和如图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A →___→____→G→ →____。装置H反应管中盛有的物质是 。
②F装置的作用是___________________________________。
③能证明草酸晶体分解产物中有CO的现象是 。
【答案】(1)H2C2O42H2O![]() CO↑+CO2 ↑+ 3H2O(1分)
CO↑+CO2 ↑+ 3H2O(1分)
(2)不能(1分),草酸晶体受热易升华,升华的草酸也会和澄清石灰水反应生成难溶物CaC2O4,不能确定是CO2和澄清石灰水反应生成的碳酸钙沉淀。(1分)
(3)①F D (1分,错一个不给分) H D(1分,同上),CuO(1分)
②除去混合气体中升华出的草酸和分解产生的二氧化碳(2分)
③H前面的澄清石灰水不变浑浊,H后面的澄清石灰水变浑浊,且H中黑色固体变成红色。(2分)
【解析】
试题分析:(1)草酸晶体在170℃以上分解为CO、CO2和H2O,则分解的化学方程式为H2C2O42H2O![]() CO↑+CO2 ↑+ 3H2O。
CO↑+CO2 ↑+ 3H2O。
(2)草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有二氧化碳生成;但由于草酸晶体受热易升华,升华的草酸也会和澄清石灰水反应生成难溶物CaC2O4,不能确定是CO2和澄清石灰水反应生成的碳酸钙沉淀;
(3)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO和CuO发生还原反应生成CO2,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO避免环境污染,所以其连接顺序是F、D、G、H、D;H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生,CuO能被CO还原且反应过程中黑色固体变为红色,现象明显,所以H中盛放的物质是CuO;
②由于升华的草酸也会和澄清石灰水反应生成难溶物CaC2O4,二氧化碳也能与氢氧化钙反应产生沉淀,所以F装置的作用是除去混合气体中升华出的草酸和分解产生的二氧化碳;
③CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,且CO将黑色的CuO还原为红色的Cu,因此能证明草酸晶体分解产物中有CO的现象是H前面的澄清石灰水不变浑浊,H后面的澄清石灰水变浑浊,且H中黑色固体变成红色。

【题目】除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的工业工程称为金属的冶炼。下列材料描述了一些常见金属的冶炼方法。
①工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁。
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气。
③湿法炼铜是工业上常用的一种炼铜的方法。使用铁和硫酸铜溶液反应。
④工业上冶炼银的方法是加热条件下让氧化银分解。
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰。
⑥相关各物质熔点见下表:
物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
Ⅰ根据上述信息回答下列问题:
(1)影响金属冶炼方法的首要因素是 。
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是 。
(3)写出铝热法冶炼锰的化学方程式 ,一般使用铝热法冶炼的金属具有哪些性质 。
Ⅱ下面是皮江法冶炼镁的工业流程示意图
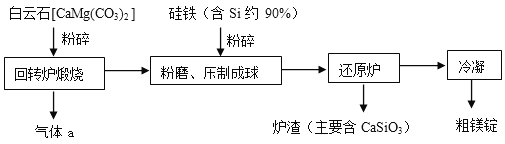
(1)气体a是 。
(2)白云石煅烧前粉碎的目的是 。
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有 、 。
(4)还原炉中抽空气到近似真空的原因是 。

