��Ŀ����
����Ŀ���ϳɰ������������ͷ�չ������Ҫ���壬1909�������ʵ�������״����õ�����������Ӧ�ϳɰ���ʵ�����˹��̵���
��1����ӦN2(g)+3H2(g)![]() 2NH3(g)�Ļ�ѧƽ�ⳣ������ʽΪ__��
2NH3(g)�Ļ�ѧƽ�ⳣ������ʽΪ__��
��2�������������ݷ�������ҵ��ѡ�õ�����������Ӧ�̵�����û��ѡ�õ�����������Ӧ�̵���ԭ����__��
��� | ��ѧ��Ӧ | K(298K)����ֵ |
�� | N2(g)+O2(g) | 5��10-31 |
�� | N2(g)+3H2(g) | 4.1��106 |
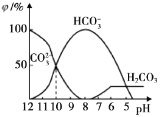
��3��ijʵ������������ͬ�������ܱ������У��ֱ����Ũ�Ⱦ�Ϊc(N2)=0.100mol/L��c(H2)=0.300mol/L�ķ�Ӧ����кϳɰ���Ӧ��N2��Ũ����ʱ��ı仯��ͼ�١��ڡ���������ʾ��
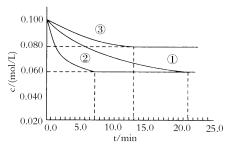
ʵ���ƽ��ʱH2��ת����Ϊ__��
��ͼ��ʾ���ڡ�����װ���и���һ��������ٲ�ͬ����ָ������˵���жϵ����ɡ�
��������___���ɣ�___��
��������___���ɣ�___��
���𰸡�K=![]() ������������Ӧ���ȣ���ѧƽ�ⳣ����Զ���ڵ�����������Ӧ���� 40% ���˴��� ��Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ������Ԣ٢���װ�ôﵽƽ��ʱN2��Ũ����ͬ �¶����� �÷�ӦΪ���ȷ�Ӧ���¶����ߣ��ﵽƽ���ʱ�����̣���ƽ�����淴Ӧ�����ƶ������е���ƽ��ʱN2��Ũ�ȸ��ڢ�
������������Ӧ���ȣ���ѧƽ�ⳣ����Զ���ڵ�����������Ӧ���� 40% ���˴��� ��Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ������Ԣ٢���װ�ôﵽƽ��ʱN2��Ũ����ͬ �¶����� �÷�ӦΪ���ȷ�Ӧ���¶����ߣ��ﵽƽ���ʱ�����̣���ƽ�����淴Ӧ�����ƶ������е���ƽ��ʱN2��Ũ�ȸ��ڢ�
��������
(1)����ƽ�ⳣ���ĸ����֪�÷�Ӧ��ƽ�ⳣ������ʽΪK=![]() ��
��
(2)ƽ�ⳣ��Խ��Ӧ�̶�Խ���ɱ������ݿ�֪������������Ӧ����(��ѧƽ�ⳣ��)Զ���ڵ�����������Ӧ�ģ���ҵ��ѡ�õ�����������Ӧ�̵�����û��ѡ�õ�����������Ӧ�̵���
(3)ʵ���ƽ��ʱH2��ת����Ϊ��(H2)=![]() ��
��
�ڵ���ƽ���ʱ��Ȣٶ̣���Ӧ���ʸ��죬������ƽ��ʱN2��Ũ�������ͬ����ѧƽ�ⲻ�ƶ����ʢ������ȼ��˴�����
�۵���ƽ���ʱ��Ȣٶ̣���Ӧ���ʸ��죬����ƽ��ʱN2��Ũ�ȸ��ڢ٣�������ƽ�����淴Ӧ�����ƶ����÷�ӦΪ���ȷ�Ӧ���ʢ��������¶����ߡ�

 ��˼ά������ҵϵ�д�
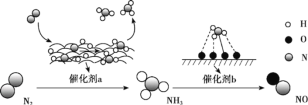
��˼ά������ҵϵ�д�����Ŀ���й��о���Ա���Ƴ�һ�������Ϲ����������̫�����ڴ�������ʵ�ָ�Ч�ֽ�ˮ������Ҫ��������ͼ��ʾ��

��֪�����������л�ѧ���ļ������±���ʾ��
��ѧ�� | H2O��H��O�� | O2��O��O �� | H2��H��H�� | H2O2��O��O�� | H2O2��O��H�� |
����kJ/mol | 463 | 496 | 436 | 138 | 463 |
����Ӧ�����зֽ���2 molˮ��������˵������ȷ����
A. �ܷ�ӦΪ2H2O![]() 2H2��+O2��
2H2��+O2��
B. ����I������926 kJ����
C. ����II�ų���574 kJ����
D. ���̢����ڷ��ȷ�Ӧ