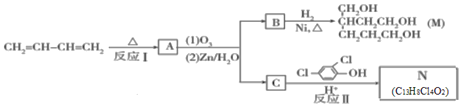
题目内容
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐是___(填化学式)。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
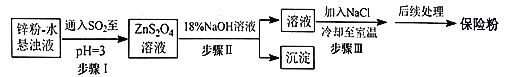
①工业上常将锌块进行预处理得到锌粉-水悬浊液,其目的是__。
②步骤Ⅰ中发生反应的化学方程式为__。
③在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是__,“后续处理”最终要加入少量的Na2CO3固体,其原因是__。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___。
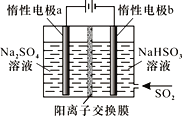
(4)有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8),并获得中国专利。电解过程中,阴极室生成Na2S2O4,a极的电极反应式为__,通过阳离子交换膜的离子主要是Na+,其迁移方向是__(填“a到b”或“b到a”)。
【答案】NaHSO3和NaHSO4 增大锌粒的表面积,加快化学反应速率 Zn+2SO2=ZnS2O4 减少Na2S2O4的溶解损失,易于干燥 Na2CO3为碱性物质,“保险粉”在碱性介质中较稳定 HCOO-+OH-+2SO2=S2O42-+CO2+H2O 2SO42--2e-=S2O82- a到b
【解析】
(1)Na2S2O4中S显+4价,在潮湿空气中氧化,S转化为+6价,则生成的两种常见酸式盐应为硫酸和亚硫酸的酸式盐。
(2)①将锌块进行预处理得到锌粉-水悬浊液,可以增大其与SO2的接触面积。
②步骤Ⅰ中,锌与SO2在水溶液中发生反应,生成ZnS2O4。
③Na2S2O4固体易溶于水,难溶于乙醇,用乙醇洗涤,从溶解和干燥两个方面寻找原因;Na2S2O4在碱性介质中较稳定,Na2CO3固体可提供碱性环境。
(3)HCOONa、烧碱、SO2发生反应,生成Na2S2O4、CO2等,由此可写出反应的离子方程式。
(4)a极的电解质为SO42-,由题意知,它将转化为S2O82-,由此可得出电极反应式;通过阳离子交换膜的离子主要是Na+,从电荷守恒出发可确定其迁移方向。
(1)Na2S2O4中S显+4价,在潮湿空气中被氧化,S部分转化为+6价,则生成的两种常见酸式盐为NaHSO3和NaHSO4。答案为:NaHSO3和NaHSO4;
(2)①锌粉-水悬浊液与SO2的接触面积比锌粉与SO2的接触面积大,反应速率快。答案为:增大锌粒的表面积,加快化学反应速率;
②步骤Ⅰ中,锌与SO2在水溶液中发生反应,生成ZnS2O4,反应的化学方程式为Zn+2SO2=ZnS2O4。答案为:Zn+2SO2=ZnS2O4;
③Na2S2O4固体易溶于水,难溶于乙醇,用乙醇洗涤,既可减少溶解损失,又易于干燥;Na2S2O4在碱性介质中较稳定,Na2CO3固体可提供碱性环境,增强“保险粉”的稳定性。答案为:减少Na2S2O4的溶解损失,易于干燥;Na2CO3为碱性物质,“保险粉”在碱性介质中较稳定;
(3)HCOONa、烧碱、SO2发生反应,生成Na2S2O4、CO2等,反应的离子方程式为HCOO-+OH-+2SO2=S2O42-+CO2+H2O。答案为:HCOO-+OH-+2SO2=S2O42-+CO2+H2O;
(4)a极的电解质为SO42-,由题意知,它将转化为S2O82-,电极反应式为2SO42--2e-=S2O82-;通过阳离子交换膜的离子主要是Na+,电极反应发生后,阳极Na+富余,它应向阴极迁移,所以Na+的迁移方向是由a到b。答案为:2SO42--2e-=S2O82-;a到b。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案