题目内容
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为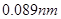 )
)

(1)B与D形成的化合物是 ;A和E形成的化合物是 。(填离子化合物或共价化合物)
(2)C的氢化物的电子式为 。
(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为: ;
(4)上述五种元素的最高价氧化物对应水化物的酸性最强的是 (填化学式);
(5)C、E形成的化合物为 、 (填化学式)
【答案】
(1)共价化合物;离子化合物
(2)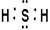
(3)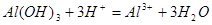
(4)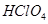
(5)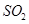 、
、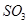
【解析】
试题分析:由已知铍的原子半径为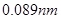 ,结合表格A、B、C、D、E的原子半径和主要化合价,可推出A为Mg, B为Al,C为S,D为Cl,E为O,,B与D形成AlCl3,是共价化合物,A与E形成MgO离子化合物。C的氢化物为H2S,其电子式为
,结合表格A、B、C、D、E的原子半径和主要化合价,可推出A为Mg, B为Al,C为S,D为Cl,E为O,,B与D形成AlCl3,是共价化合物,A与E形成MgO离子化合物。C的氢化物为H2S,其电子式为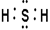 ,。
,。
(3)B的最高价氧化物的水化物是Al(OH)3
,C的最高价氧化物的水化物是H2SO4,两者反应的离子方程式为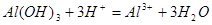
(4)由以上推出C为硫元素,E为氧元素,C、E形成的化合物为SO2和SO3。
考点:元素周期表,离子化合物,共价化合物
点评:元素周期表是历年高考常考的内容,难度不大,学生要注意挖掘题干隐含的信息,找到解题的突破口,结合平时积累的知识不难得分。

练习册系列答案
相关题目
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A、从左到右,元素周期表中的第十五列为VA族 | B、某IIA族元素的原子序数为x,则与它同周期的IIIA族元素的原子序数可能为x+25 | C、VIA族元素,随原子半径增大,对应气态氢化物的稳定性增强 | D、53号元素位于周期表中第5周期VIIA族 |
 NH4++OH-
NH4++OH-