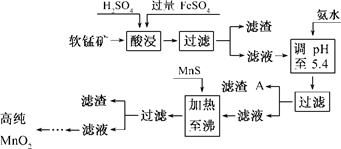
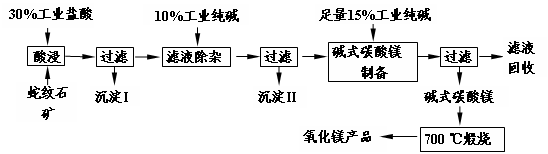
题目内容
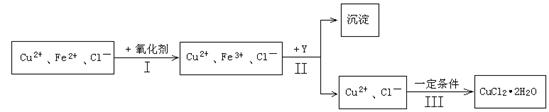
(15分)某厂用含有少量杂质FeCl2的CuCl2溶液制备纯净的CuCl2·2H2O晶体, 为降低成本且不造成空气污染,拟定实验步骤如下:
一些金属氢氧化物沉淀的PH
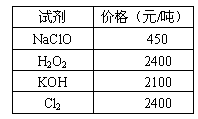
化学试剂价格表
回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母)。
A.H2O2 B.NaClO C.KOH D.Cl2
该反应的离子方程式为____________________________________________。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以选用下列物质中的________________(填字母);
A.NaOH B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生聚沉。将步骤Ⅱ中沉淀经过适当步骤制成胶体后,再逐滴加入稀硫酸可能看到的现象是_________。
(3)步骤Ⅲ应控制的实验条件是 ________________________ 。

一些金属氢氧化物沉淀的PH
| 金属离子 | PH | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 4.4 | 4.6 |

回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母)。
A.H2O2 B.NaClO C.KOH D.Cl2
该反应的离子方程式为____________________________________________。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以选用下列物质中的________________(填字母);
A.NaOH B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生聚沉。将步骤Ⅱ中沉淀经过适当步骤制成胶体后,再逐滴加入稀硫酸可能看到的现象是_________。
(3)步骤Ⅲ应控制的实验条件是 ________________________ 。
(15分,每空3分)(1)A 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
(2)① BCD ②先有红褐色沉淀出现,继续滴加硫酸溶液沉淀溶解得黄色溶液
(3)将溶液在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解。
(2)① BCD ②先有红褐色沉淀出现,继续滴加硫酸溶液沉淀溶解得黄色溶液
(3)将溶液在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解。
(1)由于在反应中不能引入新的杂质,双氧水的还原产物是是,所以答案选A。
(2)①同样在反应中不能引入新的杂质,所以氢氧化钠不能选用,BCD均是可以的,答案选BCD。
②硫酸是电解质,能使氢氧化铁胶体聚沉,生成氢氧化铁沉淀,又因为硫酸是强酸,所以能继续
溶解氢氧化铁沉淀,生成硫酸铁和水。
(3)氯化铜水解显酸性,水解是吸热的,所以加热促进水解,因此要制备氯化铜晶体,应该在在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解。
(2)①同样在反应中不能引入新的杂质,所以氢氧化钠不能选用,BCD均是可以的,答案选BCD。
②硫酸是电解质,能使氢氧化铁胶体聚沉,生成氢氧化铁沉淀,又因为硫酸是强酸,所以能继续
溶解氢氧化铁沉淀,生成硫酸铁和水。
(3)氯化铜水解显酸性,水解是吸热的,所以加热促进水解,因此要制备氯化铜晶体,应该在在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目