题目内容
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
【答案】B
【解析】
试题分析:A.a点溶液中的溶质是KaOH,氢氧化钾抑制了水的电离,溶液中氢离子是水电离的,则水电离出的c(H+)=10-pH=1×10-12molL-1,故A正确;B.b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L,故B错误;C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:c(K+)=2[c(CO32-)+c(HCO3)+c(H2CO3)],故C正确;D.d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,c(H+)=c(OH-),结合电荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),两式相减得:c(K+)=2c(CO32-)+c(HCO3-),故D正确;故选B。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
【题目】炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
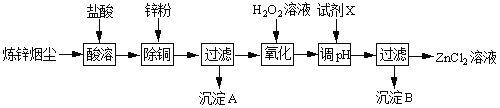
下表列出相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1.1 | 5.2 | 5.8 |
沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(1)加入H2O2溶液的作用是___。
(2)流程图中,调节pH时,加入的试剂X可以是______(填序号),pH应调整到___。
A.ZnO B.NaOH C.Zn2(OH)2CO3 D.ZnSO4