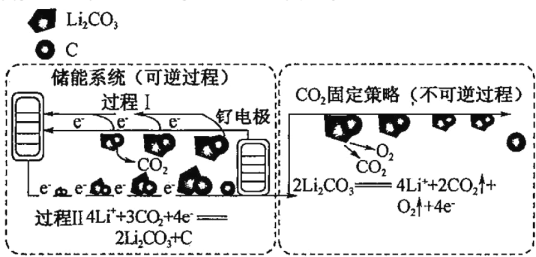
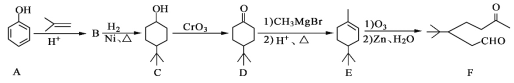
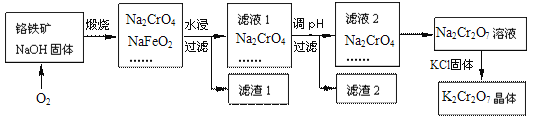
题目内容
【题目】我国研制的第二代“彩虹鱼”万米级深海着陆器所用金属材料主要是钛合金。以钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)为主要原料制钛的流程如下:

已知:① 钛在常温下不与强酸、强碱反应;② Ti4+易水解生成TiO2+, TiO2+进一步水解可得H2TiO3。
(1) “废气”中含有少量空气污染物,其分子式为________。
(2) “150-200℃溶煮”时生成Ti(SO4)2和TiOSO4且有气体产生,写出生成TiOSO4反应的化学方程式___________________________________。
(3) 沉淀池中加入Fe时,开始无气泡,溶液由棕黄色变浅绿色,片刻后有无色无味气体产生。写出Fe参与的离子反应方程式____________________________。
(4) “加热煮沸”操作的主要目的是_____________。
(5) “精炼” 阶段,从Ti、Mg混合物获得Ti时可以使用的试剂是_______________。
【答案】SO2 2FeTiO3 + 6H2SO4 ![]() Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O Fe + 2Fe3+= 3Fe2+、Fe + 2H+ = Fe2+ +H2↑ 使反应液升温并充分混合;促进Ti4+、TiO2+水解生成H2TiO3 稀盐酸(或稀硫酸)
Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O Fe + 2Fe3+= 3Fe2+、Fe + 2H+ = Fe2+ +H2↑ 使反应液升温并充分混合;促进Ti4+、TiO2+水解生成H2TiO3 稀盐酸(或稀硫酸)
【解析】
钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)加入浓硫酸150-200℃煮沸发生反应:FeTiO3+6H2SO4 ![]() Fe2(SO4)3+SO2↑+2TiOSO4+6H2O,Fe2O3、FeO溶解生成Fe2(SO4)3,得到含有Fe2(SO4)3、TiOSO4的酸性溶液,加入Fe,发生反应:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,再将溶液蒸发浓缩,冰水浴中冷却,过滤得到FeSO4·7H2O,将滤液调节pH,加热煮沸,使溶液中的TiO2+、Ti4+水解得到H2TiO3,煅烧H2TiO3得到TiO2,加入C和氯气得到TiCl4,加入镁还原得到Ti,其中混有镁,将其投入足量的稀盐酸中反应,过滤、洗涤、干燥得到纯净的Ti。
Fe2(SO4)3+SO2↑+2TiOSO4+6H2O,Fe2O3、FeO溶解生成Fe2(SO4)3,得到含有Fe2(SO4)3、TiOSO4的酸性溶液,加入Fe,发生反应:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,再将溶液蒸发浓缩,冰水浴中冷却,过滤得到FeSO4·7H2O,将滤液调节pH,加热煮沸,使溶液中的TiO2+、Ti4+水解得到H2TiO3,煅烧H2TiO3得到TiO2,加入C和氯气得到TiCl4,加入镁还原得到Ti,其中混有镁,将其投入足量的稀盐酸中反应,过滤、洗涤、干燥得到纯净的Ti。
(1) 钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)加入浓硫酸得到废气,“废气”中含有少量空气污染物,根据元素可知为SO2。
(2) “150-200℃溶煮”时生成Ti(SO4)2和TiOSO4且有SO2产生,生成TiOSO4反应的化学方程式2FeTiO3 + 6H2SO4 ![]() Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O。
Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O。
(3) 溶煮后的溶液为含有Fe2(SO4)3、TiOSO4的酸性溶液,沉淀池中加入Fe时,开始无气泡,发生反应:Fe+2Fe3+=3Fe2+,故溶液由棕黄色变浅绿色,片刻后有无色无味气体氢气产生,Fe+2H+=Fe2++H2↑;
(4) 根据流程,加热煮沸得到H2TiO3,故加热煮沸的目的是使反应液升温并充分混合,促使溶液中的TiO2+、Ti4+水解得到H2TiO3;。
(5) “精炼”阶段,Ti、Mg混合物中,Mg常温下溶于盐酸,已知:钛在常温下不与强酸、强碱反应,故从Ti、Mg混合物获得Ti的实验方案是:将混合物投入足量的稀盐酸中充分反应后,过滤、洗涤、干燥。故:“精炼” 阶段,从Ti、Mg混合物获得Ti时可以使用的试剂是稀盐酸(或稀硫酸)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案