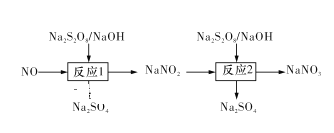
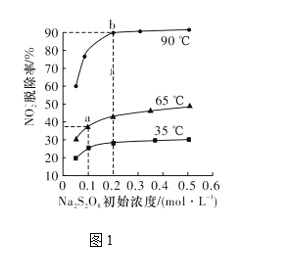
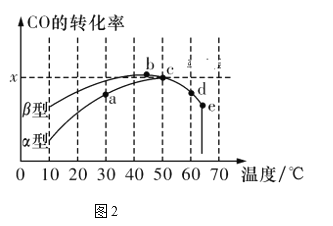
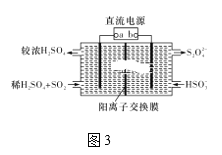
题目内容
【题目】氯气是一种重要的化工原料。氯化氢催化氧化制氯气的化学方程式为4HCl+O2  2Cl2 +2H2O。
2Cl2 +2H2O。
(1)作为氧化剂的物质是______。氯元素的化合价______(填“升高”或“降低”)。
(2)若反应中消耗了4mol HCl,则生成Cl2的物质的量为 ______mol,转移电子的物质的量为______ mol。
【答案】O2 升高 2 4
【解析】
4HCl+O2 ![]() 2Cl2+2H2O反应中氧气中氧元素的化合价降低是氧化剂,而氯化氢中氯的化合价升高是还原剂,结合氧化还原反应的规律分析解答。
2Cl2+2H2O反应中氧气中氧元素的化合价降低是氧化剂,而氯化氢中氯的化合价升高是还原剂,结合氧化还原反应的规律分析解答。
(1)4HCl+O2 ![]() 2Cl2+2H2O反应中氧气中氧元素的化合价降低是氧化剂,作为氧化剂的物质是氧气。氯元素的化合价升高氯化氢是还原剂,故答案为:O2;升高;
2Cl2+2H2O反应中氧气中氧元素的化合价降低是氧化剂,作为氧化剂的物质是氧气。氯元素的化合价升高氯化氢是还原剂,故答案为:O2;升高;
(2)氯元素的化合价由-1价升高到0价,消耗4mol HCl转移4mol的电子,生成2mol氯气,故答案为:2;4。

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目