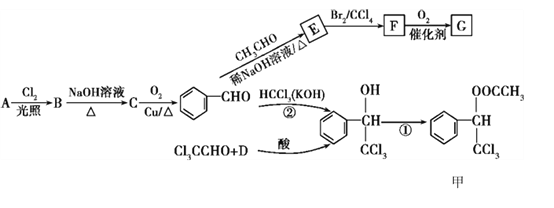
题目内容
【题目】下列四支试管中分别加入足量锌粒,在不同条件下发生反应:Zn+2H+=Zn2++H2↑。已知其他条件一定时,化学反应速率与物质的量浓度有关,请判断产生H2的反应速率最快的是 ( )
试管 | 温度 | 酸 | 水 |
① | 20℃ | 2mL 3mol·L-1H2SO4 | 8mL |
② | 20℃ | 8mL 4mol·L-1HCl | 2mL |
③ | 20℃ | 4mL 8mol·L-1CH3COOH | 6mL |
④ | 20℃ | 10mL 4mol·L-1NaHSO4 | 0 |
A. ① B. ② C. ③ D. ④
【答案】D
【解析】
根据表中数据,温度相同,主要分析氢离子浓度对反应速率的影响。
相同温度下,此反应速率主要受氢离子浓度影响,浓度越大反应越快:
A.①c(H+) =3mol·L-1×2×![]() =1.2 mol·L-1 ;
=1.2 mol·L-1 ;
B. ②c(H+) =4mol·L-1×![]() =3.2 mol·L-1 ;
=3.2 mol·L-1 ;
C. ③醋酸为弱酸,c(H+)很小;
D. ④c(H+) =4mol·L-1;
故选D

练习册系列答案
相关题目