题目内容
【题目】将11.2g铜粉和镁粉的混合物分成两等份,其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO气体2.24L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3)=2mol·L-l ②c(HNO3)=0.5mol·L-l ③m=8.0 ④m=7.2。其中正确的是( )
A.①④B.①③C.②④D.②③
【答案】B
【解析】
标况下2.24LNO的物质的量为:![]() =0.1mol,生成0.1molNO转移电子的物质的量为:0.1mol×(52)=0.3mol;铜和镁都是2价金属,根据电子守恒可知金属的物质的量为:
=0.1mol,生成0.1molNO转移电子的物质的量为:0.1mol×(52)=0.3mol;铜和镁都是2价金属,根据电子守恒可知金属的物质的量为:![]() =0.15mol,固体和硝酸恰好完全反应,反应生成硝酸铜、硝酸镁,根据N原子守恒,200mL该硝酸溶液中含有硝酸的物质的量为:0.15mol×2+0.1mol=0.4mol,该硝酸溶液的浓度为:
=0.15mol,固体和硝酸恰好完全反应,反应生成硝酸铜、硝酸镁,根据N原子守恒,200mL该硝酸溶液中含有硝酸的物质的量为:0.15mol×2+0.1mol=0.4mol,该硝酸溶液的浓度为:![]() =2mol/L,故①正确、②错误;
=2mol/L,故①正确、②错误;
铜与镁在空气中加热生成CuO、MgO,得到固体中含有氧元素的物质的量与金属的物质的量相等,则得到固体的质量为:![]() +16g/mol×0.15mol=8g,故③正确、④错误;
+16g/mol×0.15mol=8g,故③正确、④错误;
根据分析可知,正确的为①③,
答案选B。

【题目】大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样 | 所加试剂 | 实验现象 |
第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
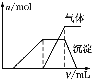
第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如图 |
|
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是____,不能确定的离子有___。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:____。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:
①最初发生的离子反应____。
②最后发生的离子反应____。
(4)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是_____。