��Ŀ����
����Ŀ�������������ĿǰΪֹ������ǿ���������ô�����Ԥ����δ��20������������������������Ĵ��Բ��ό��֡������������������Ҫԭ������ϡ�������ϡ��������������Լ�����ϡ��ԭ�ϡ�
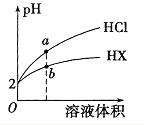
(1) ��(Nd)Ϊ60��Ԫ�أ������ڱ��е�______���ڣ���̬��ԭ�ӵ���Χ�����Ų�ʽΪ______
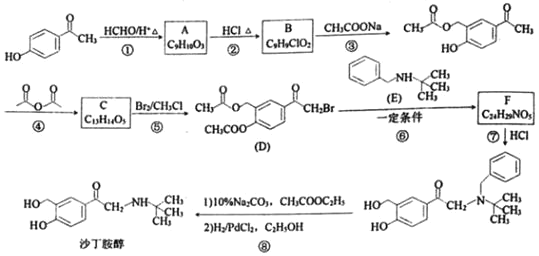
(2) ʵ����AlCl3��ʵ�ʴ�����ʽΪAl2Cl6������ӵ����ģ����ͼ��ʾ��

�� ��֪Al2Cl6������������������غϣ���Al2Cl6����_________����(���������������Ǽ�����)��������A1ԭ��ȡ______�ӻ���
�� Al2Cl6�����NaOH��Һ��Ӧ����Na[Al(OH)4]��[A1(OH)4]���д��ڵĻ�ѧ����_____ (��ѡ����ĸ)��
A.���Ӽ� B.���ۼ� C.������ D.��λ�� E.���
(3) BԪ�ؼ�����ͬ�������ڵ�����Ԫ�ص�һ��������С�����˳��Ϊ______(��Ԫ�ط��ű�ʾ)��BԪ�ؿ���һ������������H3O+ [B(OH)F3]�� ���û������е縺������Ԫ�ص�ԭ���У������ܲ���ӵĵ���������ͼ��״��______��
(4) ������к��д������Ϻ�����������ʴ������һ�����㡣�ɵ����(Ni)��п(Zn)�Ƚ��б���Ϳ�㴦������֪Ni�����γ�[Ni(NH3)6]Cl2�����������������ӵĿռ乹��Ϊ _______ ��
(5) ��֪����BN����Ӳ���࣬�侧���ṹ��ͼ��ʾ���辧���������B��Nԭ��֮��ľ���Ϊanm��������ܶ�Ϊbg��cm��3�����ӵ�����Ϊ_________ mol��1(�ú�a��b�Ĵ���ʽ��ʾ)

���𰸡��� 3d64s2 �Ǽ��� sp3 BD B��Be��C 2 ������ ![]() ��1021
��1021
��������
(1) ��(Nd)Ϊ60��Ԫ�أ�����ϡ�������ԭ�����������жϣ���Ϊ26��Ԫ�أ��ݴ���д��̬��ԭ�ӵ���Χ�����Ų�ʽ��
(2)��Al2Cl6������������������غϣ�ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ�����Al3+��OH-֮��Ϊ��λ����O��H֮����ڹ��ۼ���
(3) ����ͬ���ڵ�һ�����ܵı仯�����жϣ�Ԫ�صķǽ�����Խǿ���縺��Խ�û������е縺������Ԫ����F������F�ĵ����Ų�ʽ�ж������ܲ���ӵĵ���������ͼ��״��
(4) [Ni(NH3)6]Cl2���������Ϊ���������ݼ۲���Ӷ���=�������Ӷ���+�µ��Ӷ���=�������Ӷ���+![]() (a-xb)����Nԭ�ӵļ۲���Ӷ��������жϿռ乹�ͣ�
(a-xb)����Nԭ�ӵļ۲���Ӷ��������жϿռ乹�ͣ�
(5) ���ݾ�̯������ÿ�������к��е�Nԭ�ӡ�Bԭ����Ŀ���ټ��㾧���������������������B��Nԭ��֮��ľ���Ϊanm��Ϊ������Խ��ߵ�![]() ���ɴ˼��㾧�����ⳤ��ȷ������������������ݾ������ܶ���ʽ���㡣
���ɴ˼��㾧�����ⳤ��ȷ������������������ݾ������ܶ���ʽ���㡣
(1) ��(Nd)Ϊ60��Ԫ�أ�����ϡ�������ԭ��������֪��60��54��Ϊ�����������(Nd)�����ڱ��ĵ�6���ڢ�B�壻��Ϊ26��Ԫ�أ���̬��ԭ�ӵ���Χ�����Ų�ʽΪ3d64s2���ʴ�Ϊ��6��3d64s2��
(2)��Al2Cl6������������������غϣ����ڷǼ��Է��ӣ�ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ���Al��ȡsp3�ӻ����ʴ�Ϊ���Ǽ��ԣ�sp3��
��[A1(OH)4]����Al3+��OH-֮��Ϊ��λ����O��H֮����ڹ��ۼ����ʴ�Ϊ��BD��
(3) ͬһ���ڣ������ң�Ԫ�صĵ�һ�����ܳ��������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�BԪ�ؼ�����ͬ�������ڵ�����Ԫ�ص�һ��������С�����˳��ΪB��Be��C��BԪ�ؿ���һ������������H3O+ [B(OH)F3]����Ԫ�صķǽ�����Խǿ���縺��Խ�û������е縺������Ԫ����F����̬Fԭ�ӵĵ����Ų�ʽΪ1s22s22p5�������ܲ���ӵĵ���������ͼ��״��2�֣��ʴ�Ϊ��B��Be��C��2��
(4) [Ni(NH3)6]Cl2���������Ϊ������Nԭ�ӵļ۲���Ӷ���=3+![]() =4��N����sp3�ӻ����ռ乹��Ϊ�����Σ��ʴ�Ϊ�������Σ�
=4��N����sp3�ӻ����ռ乹��Ϊ�����Σ��ʴ�Ϊ�������Σ�
(5) ��ͼ��֪ÿ�������к�4��Nԭ�ӣ�Bԭ����Ϊ8��![]() +6��
+6��![]() =4��ÿ������������=
=4��ÿ������������=![]() g�������������B��Nԭ��֮��ľ���Ϊanm��Ϊ������Խ��ߵ�
g�������������B��Nԭ��֮��ľ���Ϊanm��Ϊ������Խ��ߵ�![]() �������ⳤ=
�������ⳤ=![]() a nm=
a nm=![]() a��10-7 cm����˾������ܶ�bg��cm��3=
a��10-7 cm����˾������ܶ�bg��cm��3=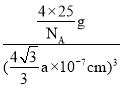 ����ã�NA=
����ã�NA=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��