题目内容
8.(1)向NH4Cl、AlCl3、MgCl2混合溶液中逐滴加入NaOH至过量,按反应的先后顺序,写出有关的离子方程式:①Al3++3OH-═Al(OH)3↓,Mg2++2OH-═Mg(OH)2↓; ②NH4++OH-═NH3•H2O; ③Al(OH)3+OH-═AlO2-+2H2O.
(2)含硫化合物的种类很多,常见的有:SO2、Na2SO4、H2SO4、CuSO4等.
①向含FeCl3和BaCl2的酸性溶液中通入SO2,有白色沉淀生成,此沉淀是
②我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来减少SO2的污染,写出该反应的化学方程式
③Na2SO3和KIO3在酸性溶液中发生的反应叫碘酸盐型“碘钟”反应,常用淀粉作指示剂,写出KIO3过量时该氧化还原反应的离子方程式
(3)实验室用固体烧碱配制500mL 0.1mol•L-1的NaOH溶液.
①需称量2.0g的烧碱固体,它应该盛放在烧杯中进行称量.
②配制过程中,不需要使用的仪器是(填写代号)CH.
A.烧杯 B.漏斗 C.1000mL容量瓶 D.托盘天平 E.药匙 F.500mL容量瓶 G.胶头滴管
③除上述可使用的仪器,还缺少的仪器是玻璃棒,在实验中的作用搅拌、引流.
分析 (1)向NH4Cl、AlCl3、MgCl2混合溶液中逐滴加入NaOH至过量,依次发生铝离子与氢氧根离子、镁离子反应生成沉淀,然后铵根离子与氢氧根离子反应生成一水合氨,氢氧化铝与氢氧根离子反应生成偏铝酸根离子;
(2)①三价铁离子能够氧化二氧化硫生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀;
②一氧化碳与二氧化硫反应生成硫与二氧化碳;
③亚硫酸钠具有强的还原性,碘酸钾在酸性环境下具有强的氧化性,二者反应生成硫酸钠、硫酸钾和水、碘;
(3)①依据m=CVM计算溶质的质量;氢氧化钠具有腐蚀性,应放在小烧杯中称量;
②③依据配制一定物质的量浓度溶液的步骤选择合适的仪器,依据玻璃棒在溶解和移液时作用解答.
解答 解:(1)向NH4Cl、AlCl3、MgCl2混合溶液中逐滴加入NaOH至过量,依次发生铝离子与氢氧根离子、镁离子反应生成沉淀,然后铵根离子与氢氧根离子反应生成一水合氨,氢氧化铝与氢氧根离子反应生成偏铝酸根离子,离子方程式分别为:①Al3++3OH-═Al(OH)3↓,Mg2++2OH-═Mg(OH)2↓②NH4++OH-═NH3•H2O ③Al(OH)3+OH-═AlO2-+2H2O;
故答案为::①Al3++3OH-═Al(OH)3↓,Mg2++2OH-═Mg(OH)2↓②NH4++OH-═NH3•H2O ③Al(OH)3+OH-═AlO2-+2H2O;
(2)①向含FeCl3和BaCl2的酸性溶液中通入SO2,酸性环境下三价铁离子氧化二氧化硫生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,
故答案为:BaSO4或硫酸钡;
②一氧化碳与二氧化硫反应生成硫与二氧化碳,化学方程式:2CO+SO2$\frac{\underline{\;一定条件\;}}{\;}$S+2CO2;
故答案为:2CO+SO2$\frac{\underline{\;一定条件\;}}{\;}$S+2CO2;
③亚硫酸钠与碘酸钾在酸性环境下反应的离子方程式:5SO32-+2IO3-+2H+═5SO42-+I2+H2O;
故答案为:5SO32-+2IO3-+2H+═5SO42-+I2+H2O;
(3)①配制500mL 0.1mol•L-1的NaOH溶液,需要氢氧化钠的质量=0.1mol/L×40g/mol×0.5L=2.0g;氢氧化钠为腐蚀性物质,应放在小烧杯中称量;
故答案为:2.0;小烧杯;
②操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以不需要的仪器是:CH;
故答案为:CH;
③除了上述仪器还缺少玻璃棒,在溶解时,起搅拌作用,在移液时起引流作用;
故答案为:玻璃棒;搅拌、引流.
点评 本题为综合题,涉及离子方程式书写、一定物质的量浓度溶液的配制,熟悉离子反应的实质及配制一定物质的量浓度溶液的步骤是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 8mL | B. | 9mL | C. | 10mL | D. | 12mL |
| A. | 已知30℃时Kw=3.80×10-14,则30℃时c(H+)=1.00×10-7mol/L的溶液是酸性的 | |
| B. | 正常成人胃液的pH=1.4,婴儿(体温与成人相同)胃液的pH=5.0,鉴于人的正常体温不是25℃,故两种胃液的c(OH-)不可能相差103.6倍 | |
| C. | 新制氯水中加入少量的NaHSO3晶体不会使c(HClO)增大 | |
| D. | 在熔融状态下,1molKHSO4完全电离出的阳离子数目为2NA |
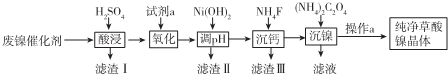
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等.
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)pH的调控范围为5.0~6.8,试用化学反应原理的相关知识解释滤渣Ⅱ的生成.
(4)写出“沉镍”时反应的离子方程式Ni2++C2O42-+2H2O=NiC2O4•2H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成,当Ca2+沉淀完全时,溶液中c(F-)>$\sqrt{\frac{1.46×10{\;}^{-10}}{1{0}^{-5}}}$ mol/L(写出计算式即可).
(5)操作a的内容是过滤、洗涤、干燥.
| A. | H2O2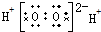 | B. | MgCl2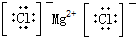 | C. | HClO  | D. | CCl4 |
| A. | 因反应太剧烈,可用分液漏斗控制滴水速度来控制反应速度 | |
| B. | 为了得到比较平缓的乙炔气流,可用饱和食盐水代替水 | |
| C. | 乙炔气体中混有PH3和H2S等杂质,可用硫酸铜溶液将其除去 | |
| D. | 为控制反应的速率,可用碳化钙粉末和饱和食盐水反应 |
 .
.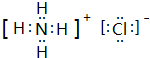 ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键. .
.