题目内容
19.常温下将盛有10mLNO2和10mLNO混合气体的试管倒立于水槽中,并向其中通入O2一段时间后,试管内剩余2mL气体,则通入O2的体积为( )| A. | 8mL | B. | 9mL | C. | 10mL | D. | 12mL |
分析 剩余的气体可能为氧气,有可能为NO,若为氧气,根据4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O═4HNO3求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,可以看作二氧化氮完全反应,NO反应消耗了8mL,还剩余2mL,然后根据反应方程式计算出消耗的氧气的体积
解答 解:若剩余气体为O2,10mLNO2和10mL NO说明完全反应生成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 10mL 7.5mL
所以通入的氧气体积为:2.5mL+7.5mL+2mL=12mL;
若剩余的气体为NO时,可以认为10mL NO2完全反应生成硝酸,10mLNO中剩余2mL,有8mL转化成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 8mL 6mL
所以通入氧气的体积为:2.5mL+6mL=8.5mL,
故选:D.
点评 本题考查混合物有关计算,难度中等,关键是分析剩余气体的成分,注意利用总反应方程式计算,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
9.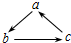 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 物质 选 项 | a | b | c |
| A | Si | SiO2 | H2SiO3 |
| B | H2SO4 | SO2 | SO3 |
| C | Al | AlCl3 | Al(OH)3 |
| D | NaCl | Na | NaOH |
| A. | A | B. | B | C. | C | D. | D |
10.下步表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
| 化合物/选项 | A | B | C | D |
| Y | H2O | Fe2O3 | C2H5OH | FeCl3 |
| W | Fe3O4 | Al2O3 | C2H5ONa | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
7.最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氢原子核(只含质子)和2个电子构成的.对于这种微粒,下列说法中正确的是( )
| A. | 是氢的一种新的同素异形体 | B. | 是氢的一种新的同位素 | ||
| C. | 它的组成可用H${\;}_{3}^{+}$表示 | D. | 它的化学性质与氢气相似 |
4.等物质的量的CH4、C2H4、C2H2分别在足量的氧气中充分燃烧,以下说法错误的( )
| A. | CH4、C2H4燃烧生成水的质量相同,消耗氧气不同 | |
| B. | C2H4燃烧生成水与CO2的物质的量相等 | |
| C. | CH4含氢量最高,燃烧生成水最多 | |
| D. | C2H2含碳量最高,燃烧生成的CO2最多 |
9.目前含有元素硒(Se)的保健品已开始涌入市场,已知它与氧同主族,而与钾同周期,下列关于硒的有关描述中错误的是( )
| A. | 原子序数34 | B. | 最高价氧化物为SeO2 | ||
| C. | 原子半径比钾小 | D. | 气态氢化物化学式为H2Se |
 ;
; .
.