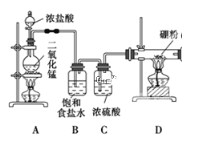
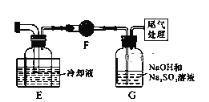
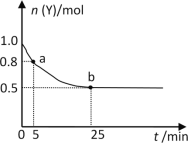
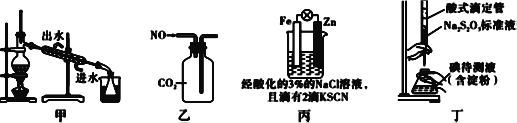
题目内容
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如图:
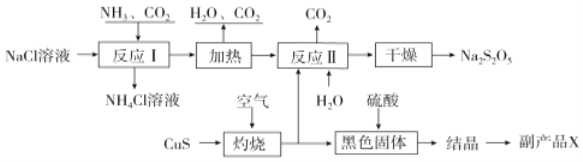
已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:______。
(2)反应I的化学方程式为______。
(3)“灼烧”时发生反应的化学方程式:______。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为______。
(5)副产品X的化学式是______。
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2CuS+3O2
2NH3↑+CaCl2+2H2O NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2CuS+3O2![]() 2CuO+2SO2 S2O52-+2H+=2SO2↑+H2O CuSO4·5H2O
2CuO+2SO2 S2O52-+2H+=2SO2↑+H2O CuSO4·5H2O
【解析】
由制备流程可知,反应Ⅰ为生成NaHCO3,加热生成Na2CO3。在CuS在空气中灼烧,得到SO2,SO2通入Na2CO3溶液中,制得NaHSO3。加热NaHSO3生成Na2S2O5。黑色固体为CuO,加入硫酸变成硫酸铜溶液,结晶可得副产品。
(1)氯化铵和氢氧化钙固体混合加热制氨气,发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
(2)流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和NaHCO3,反应Ⅰ的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为:2CuS+3O2![]() 2CuO+2SO2;
2CuO+2SO2;
(4)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为S2O52-+2H+=2SO2↑+H2O;
(5)上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,副产品X的化学式是CuSO4·5H2O。

 名校课堂系列答案
名校课堂系列答案【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物