题目内容
【题目】
工业上以Ni的氧化物作催化剂,将丙烯胺氧化制得丙烯腈(CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,控制pH在8 5-9 0范围内,电解丙烯腈制己二腈、电解的总化学方程式为:4CH2=CHCN +2H2O![]() O2↑+2NC(CH2)4CN
O2↑+2NC(CH2)4CN
(1)Ni原子的核外电子排布式为____________________;在电解的总化学方程式所涉及的元素中,电负性由小到大的顺序为_________________________。
(2)PO43-的空间构型是_____________,CH2=CHCN中碳原子的杂化方式为__________________。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_________________________。
(4)已知K3PO4是离子晶体,写出其主要物理性质______________(写出2条即可)。
(5)该电解总化学方程式中各元素组成的下列物质中,存在分子内氢健的是_________(填标号)。
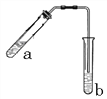
A.NH3 B.H2O2 C. 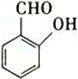 D.
D. 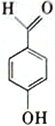
(6)金刚石的晶胞结构如右图。该晶胞中C原子数为_____________,若金刚石晶胞的密度是d g·cm-3,阿伏加德罗常数为NA,则金刚石晶胞中两个碳原子之间的最短距离为_____________。(用含d、NA的式子表示,只需要列出表达式即可)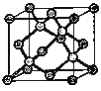
【答案】 1s22s22p63s23p63d84s2 H<C<N<O 正四面体 sp、sp2 15∶4 熔融时能导电、熔点较高、硬度较大 C 8 ![]()
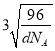 cm
cm
【解析】(1)Ni为28号元素,原子的核外电子排布式为1s22s22p63s23p63d84s2;在电解的总化学方程式4CH2=CHCN +2H2O![]() O2↑+2NC(CH2)4CN,涉及的元素有C、H、O、N,元素的非金属越强,电负性数值越大,电负性由小到大的顺序为H<C<N<O,故答案为:1s22s22p63s23p63d84s2;H<C<N<O;
O2↑+2NC(CH2)4CN,涉及的元素有C、H、O、N,元素的非金属越强,电负性数值越大,电负性由小到大的顺序为H<C<N<O,故答案为:1s22s22p63s23p63d84s2;H<C<N<O;
(2)PO43-中的P原子与4个原子相连,没有孤对电子,空间构型为正四面体;CH2=CHCN的结构可以改写为CH2=CHC≡N,其中碳原子的杂化方式有sp、sp2,故答案为:正四面体;sp、sp2;
(3)单键为σ键,双键为1个σ键和1个π键,三键为1个σ键和2个π键,NC(CH2)4CN分子中σ键与π键数目之比为15∶4,故答案为:15∶4;
(4)K3PO4是离子晶体,主要物理性质有熔融时能导电、熔点较高、硬度较大、易溶于水,故答案为:熔融时能导电、熔点较高、硬度较大、易溶于水等;
(5)A.NH3存在分子间氢键,错误;B.H2O2存在分子间氢键,错误; C. 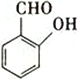 中羟基和醛基距离较近,容易形成分子内氢键,正确;D.
中羟基和醛基距离较近,容易形成分子内氢键,正确;D. 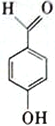 中羟基和醛基距离较远,容易形成分子间氢键,错误;故选C;
中羟基和醛基距离较远,容易形成分子间氢键,错误;故选C;
(6)根据金刚石的晶胞结构图,该晶胞中C原子数为8×![]() +6×
+6×![]() +4=8;设晶胞的边长为x,则d g·cm-3=
+4=8;设晶胞的边长为x,则d g·cm-3=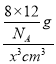 ,解得x=
,解得x=![]() cm,金刚石晶胞中两个碳原子之间的最短距离为体对角线的
cm,金刚石晶胞中两个碳原子之间的最短距离为体对角线的![]() ,因此金刚石晶胞中两个碳原子之间的最短距离为,故答案为:8;
,因此金刚石晶胞中两个碳原子之间的最短距离为,故答案为:8; 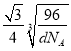 cm。
cm。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
元素编号 | 元素性质或原子结构 |
X | X原子的最外层电子数是其内层电子总数的2倍 |
Y | Y的基态原子价电子排布式为nsnnpn+2 |
Z | 最外层中只有两对成对电子 |
W | 前四周期基态原子中,W元素的未成对电子数最多 |
(1)元素X最高价氧化物分子的空间构型是__________________,是_________(填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是____________________________________
(3)基态Z原子中,电子占据的最高电子层符号为_________,该电子层具有的原子轨道数为________________
(4)元素W位于元素周期表的第________族。