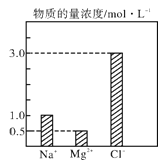
题目内容
【题目】为探究铁和硫反应产物中铁的化合价,某同学设计了如下所示的实验过程:
![]()
已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2 和 NaOH 溶液的化学反应下列说法不正确的是
A.混合粉末应在 N2 氛围中进行加热,所用 H2SO4 溶液应先煮沸
B.取溶液 A,滴加 KSCN 溶液,未出现红色,可证明铁和硫反应只有+2 价铁生成
C.滤渣用稀 H2SO4 溶解时应在通风橱中进行
D.硫溶于热碱溶液可能发生的离子反应是3S+6OH-![]() 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
【答案】B
【解析】
探究铁和硫反应产物实验流程:为防止Fe和S被氧气氧化,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,S粉必须要过量,保证铁粉完全反应,避免过量的铁粉与硫酸反应生成Fe2+而干扰实验,在黑色固体中加入热的氢氧化钾溶液,发生反应:3S+6KOH![]() 2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验。
2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验。
A.为防止Fe和S被氧气氧化,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验,故A正确;
B.题中末说明硫粉是否过量,可能发生Fe+2Fe3+=3Fe2+,取溶液 A,滴加 KSCN 溶液,未出现红色,不能证明铁和硫反应只有+2 价铁生成,故B错误;
C.滤渣FeS用稀 H2SO4 溶解时会产生H2S,有毒,应在通风橱中进行,故C正确;
D.硫溶于热碱溶液可能发生3S+6KOH![]() 2K2S+K2SO3+3H2O,离子反应是3S+6OH-
2K2S+K2SO3+3H2O,离子反应是3S+6OH-![]() 2S2-+SO32-+3H2O,故D正确;
2S2-+SO32-+3H2O,故D正确;
故选B。

练习册系列答案
相关题目