题目内容
(1) 甲烷的分子个数为1.204×1023,则甲烷的物质的量为______ mol,所含的原子个数共有______个,与这些甲烷质量相等的O2的物质的量为 ______________ mol。
(2)含有相同氧原子数目的NO和NO2两种气体,其质量比 ,物质的量比为 ,在标准状态下,体积比为 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为________。
②所得溶液中Cl-的物质的量为________mol。
③所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
(2)含有相同氧原子数目的NO和NO2两种气体,其质量比 ,物质的量比为 ,在标准状态下,体积比为 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为________。
②所得溶液中Cl-的物质的量为________mol。
③所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
(9分)(1)0.2 ,NA,0.1(2)30:23,2:1,2:1
(3)、(1) 10.71% (2)0.250 mol (3)3︰2
(3)、(1) 10.71% (2)0.250 mol (3)3︰2
(1)甲烷的分子个数为1.204×1023,则甲烷的物质的量为1.204×1023÷6.02×1023/mol=0.2mol;所含的原子个数共有0.2×5×NA=NA;甲烷的质量是16g/mol×0.2mol=3.2g,所以氧气的物质的量是3.2g÷32g/mol=0.1mol。
(2)含有相同氧原子数目的NO和NO2两种气体,其物质的量之比是2︰1,所以质量之比是2×30︰1×46=30︰23;在标准状态下,体积比就是物质的量之比,因此也是2︰1。
(3)①根据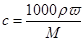 可知,氢氧化钠的质量分数是
可知,氢氧化钠的质量分数是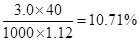 。
。
②测得溶液中含有NaClO的物质的量为0.050 0 mol,则氯化钠的物质的量是0.3mol-0.0500mol=0.25mol、
③根据反应的方程式Cl2+2NaOH=NaCl+NaClO+H2O可知,生成0.0500mol次氯酸钠的同时还生成0.050mol氯化钠,所以由氯化氢生成的氯化钠是0.25mol-0.0500mol=0.2mol。因此生成的氯化氢是0.2mol,剩余的氯气是0.05mol,所以所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=0.15︰0.1=3︰2。
(2)含有相同氧原子数目的NO和NO2两种气体,其物质的量之比是2︰1,所以质量之比是2×30︰1×46=30︰23;在标准状态下,体积比就是物质的量之比,因此也是2︰1。
(3)①根据
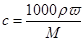 可知,氢氧化钠的质量分数是
可知,氢氧化钠的质量分数是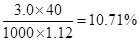 。
。②测得溶液中含有NaClO的物质的量为0.050 0 mol,则氯化钠的物质的量是0.3mol-0.0500mol=0.25mol、
③根据反应的方程式Cl2+2NaOH=NaCl+NaClO+H2O可知,生成0.0500mol次氯酸钠的同时还生成0.050mol氯化钠,所以由氯化氢生成的氯化钠是0.25mol-0.0500mol=0.2mol。因此生成的氯化氢是0.2mol,剩余的氯气是0.05mol,所以所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=0.15︰0.1=3︰2。

练习册系列答案
相关题目
 CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入过量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入过量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。