题目内容
NA代表阿伏加德罗常数。下列有关叙述正确的是
| A.标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B.20g重水(D2O)所含的电子数为10NA |
| C.标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA |
| D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
B
解析试题分析:H2O是液体,而不是气体,水分子的物质的量不等于0.1mol,而是远远大于0.1mol,故A错误;重水的式量和电子数分别为20、10,n(D2O)=20g÷20g/mol=1mol,1mol重水含有10mol或10NA个电子,故B正确;n(Cl2)=2.24L÷22.4L/mol=0.1mol,Cl2+2NaOH(过量)=NaCl+NaClO+H2O~e―,Cl2既是氧化剂又是还原剂,则0.1mol Cl2完全反应转移0.1mol或0.1NA个电子,故C错误;Kw =10―14,c(H+)=10―13mol/L,c(OH―)=Kw/ c(H+)=0.1mol/L,n(OH―)= 0.1mol/L×1.0L=0.1mol,则OH-数目为0.1NA,故D错误。
考点:考查阿伏加德罗常数的应用,虽然根据V/Vm或m/M或c·V直接计算物质的量,但是要注意有关计算公式的适用范围,确定转移电子数需要准确判断变价元素化合价升降数及变价原子个数,已知pH的实质是已知离子浓度,而不是电解质的浓度,不需要再乘以电解质化学式中下角标的数字。

练习册系列答案
相关题目
下列化学用语正确的是
A.乙烯的比例模型: |
| B.HClO的结构式为:H—Cl—O |
C.H2O2的电子式: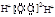 |
| D.乙醇的分子式:CH3CH2OH |
下列表述正确的是
| A.中子数为10的氧原子:18 10O |
B.Na2S的电子式: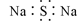 |
| C.聚氯乙烯的结构简式:CH2CHCl |
| D.Mg5(Si4O10)2(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,224 mL水含有的电子数为0.1NA |
| B.1L 0.1mol/L硅酸钠溶液中含有0.1NA个SiO32¯ |
| C.标准状况下,11.2 LCO2和SO2混合气体中含NA个氧原子 |
| D.足量的铁粉与1mol Cl2加热条件下充分反应,转移的电子数为3NA |
下列有关化学用语表示正确的是
A.羧基电子式 |
B.O2-的结构示意图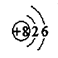 |
C.质子数35,中子数44的溴原子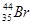 |
D.Al(OH)3在水溶液中的电离方程式H++H2O+AlO2- AI(OH)3 AI(OH)3 Al3++3OH- Al3++3OH- |
若阿伏加德罗常数的数值为NA,则下列说法中正确的是
| A.1.0L0.1 mol·L-1Na2S溶液中含有的S2-离子数小于0.1NA |
| B.1 molFe与过量的氯气反应,转移电子的数目为2 NA |
| C.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| D.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
NA表示阿伏加德罗常数值。下列说法正确的是
| A.1mol Na2O2与足量CO2充分反应转移的电子数为2NA |
| B.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA |
| C.向FeI2溶液中通入适量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目为NA |
| D.t℃时,1L pH=6的纯水中,含1×10—6 NA个OH— |
设NA为阿伏加德罗常数,则下列叙述正确的是
| A.标准状况下,2.24 L苯中含有0.3NA个碳碳双键 |
| B.22.4LCl2通入水中充分反应,共转移NA个电子 |
| C.1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA |
| D.5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |
下列化学用语表达正确的是
A.磷原子的原子结构示意图: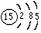 |
B.钠离子的电子式: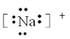 |
C.甲烷的结构式: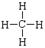 |
| D.质子数为8,中子数为10的核素:10O |