题目内容
若阿伏加德罗常数的数值为NA,则下列说法中正确的是
| A.1.0L0.1 mol·L-1Na2S溶液中含有的S2-离子数小于0.1NA |
| B.1 molFe与过量的氯气反应,转移电子的数目为2 NA |
| C.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| D.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
A
解析试题分析:n(Na2S)=0.1mol·L-1×1.0L=0.1mol,Na2S =2Na++ S2-,n(S2-)= n(Na2S)=0.1mol,但是Na2S是强碱弱酸盐,S2-能水解,则溶液中n(S2-)<0.1mol,故A正确;根据氯气的性质可知,2Fe+3Cl2=2FeCl3~6e-,根据系数之比等于物质的量之比可知,1mol铁与过量氯气反应转移3mol电子,故B错误;缺少标准状况下,气体摩尔体积不一定等于22.4L/mol,则混合气体不一定为0.1mol,所含碳原子不一定为0.1mol,故C错误;n(H2SO4)="18.4" mol·L-1×0.05L=0.92mol,Cu+2H2SO4(浓)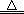 CuSO4+SO2↑+2H2O,但是生成的n(SO2)一定小于0.46mol,因为铜足量,浓硫酸变为稀硫酸,所以参加上述反应的n(H2SO4)一定小于0.92mol,故D正确。
CuSO4+SO2↑+2H2O,但是生成的n(SO2)一定小于0.46mol,因为铜足量,浓硫酸变为稀硫酸,所以参加上述反应的n(H2SO4)一定小于0.92mol,故D正确。
考点:考查阿伏加德罗常数,涉及盐类水解、氧化还原反应转移电子数、气体摩尔体积、物质的量浓度、浓硫酸的稀释等知识。

练习册系列答案
相关题目
下列化学用语正确的是( )
A.14C原子结构示意图: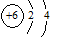 |
B.硝基苯的结构简式: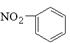 |
C.NH4Cl的电子式: |
| D.FeS2中S的化合价:?2 |
设NA表示阿伏加德罗常数的值。下列叙述不正确的是
| A.1 mol Na2O和Na2O2的混合物中含有的阴、阳离子总数是3NA |
| B.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA |
| C.46 g有机物C2H6O中含有的H—O键的数目为NA |
| D.标准状况下,将0.1 mol Cl2通入足量NaOH溶液中,反应转移的电子数为0.1NA |
下列有关化学用语表示正确的是
A.Cl-的结构示意图: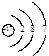 |
B.次氯酸的结构式: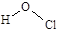 |
C.CH3F的电子式: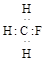 |
D.CO2的分子比例模型: |
NA代表阿伏加德罗常数。下列有关叙述正确的是
| A.标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B.20g重水(D2O)所含的电子数为10NA |
| C.标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA |
| D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
若nA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,5.6LCCl4含有的C-Cl共价键数为nA |
| B.2.4gMg与足量稀硫酸反应时,失去电子数为0.1nA |
| C.l L0.5mol. L-1CuCl2溶液中含有的Cu2+数为0.5 nA |
| D.16g氧气和臭氧的混合物中氧原子数为nA |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,11.2 L CH3OH中含有C-H键1.5NA |
| B.9g18 8O2中含有的中子数为5NA |
| C.1 L pH=1的硫酸溶液中含有的H+数为0.2NA |
| D.1 mol Cu与足量S完全反应生成Cu2S,转移电子数为2NA |
设nA为阿伏加德罗常数的值,下列说法正确的是(相对原子质量:C-l2 H-1)
| A.2.24L NO2含有0.2nA个氧原子 |
| B.常温常压下,C2H4和C3H6组成的28g混合气体中含4nA个氢原子 |
| C.1 molC2H6分子中含有7nA个极性键 |
| D.常温下pH=13的NaOH溶液中含有的0.1 nA个OH- |
已知25%的氨水的密度为0.91 g/ml,5%的氨水密度为0.98 g/ml,若将上述两种氨水等体积混合,所得氨水的质量分数 ( )
| A.等于15% | B.大于15% | C.小于15% | D.无法确定 |