题目内容
9.下列说法正确的是( )| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H>0,△S>0 | |
| B. | 水解反应NH+4+H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | 铅蓄电池放电时的负极和充电时的阳极均发生还原反应 | |
| D. | 室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中导电粒子的数目减少. |
分析 A、物质的分解反应是吸热反应,生成物气体的量高于反应物中气体的量,熵变大于零;
B、升高温度水解平衡正向移动;
C、原电池的正极和电解池的阴极均发生得电子的还原反应;
D、醋酸是弱电解质,加水稀释促进醋酸电离.
解答 解:A、反应MgCl2(1)=Mg(1)+Cl2(g)属于分解反应,是吸热反应,△H>0,生成物气体的量高于反应物中气体的量,熵变大于零,故A正确;
B、水解过程是吸热的过程,升高温度,水解平衡正向移动,故B错误;
C、铅蓄电池放电时的负极和充电时的阳极发生氧化反应,故C错误;
D、醋酸是弱电解质,加水稀释促进醋酸电离,导致溶液中阴阳离子数目增大,故D错误.
故选A.
点评 本题考查学生原电池和电解池的工作原理以及化学平衡移动的方向知识,注意教材知识的灵活应用是解题的关键,难度不大.

练习册系列答案
相关题目
19.下列各组数据中,前者一定比后者大的是( )
| A. | 常温下,浓度相同的NH4HCO3溶液和NH4Cl溶液中的c(NH4+) | |
| B. | 物质的量浓度均为0.1mol•L-1的醋酸溶液和盐酸中的pH | |
| C. | 0.1mol•L-1的Na2CO3溶液中c(HCO3-)和c(CO32-) | |
| D. | 0.1mol•L-1的NaHSO3溶液中c(H2SO3)和c(SO32-) |
20.下列叙述从化学角度分析,其中不正确的是( )
| A. | 蜂蚁蜇咬人的皮肤时.会将分泌物甲酸注入人体,使人感到疼痛难忍,涂抹稀氨水或者碳酸氢钠溶液可以减轻疼痛 | |
| B. | 氟得昂(CF2Cl2)或NO2都可破坏臭氧层而导致“温室效应” | |
| C. | 向燃料煤中加入生石灰,可减少对大气的污染 | |
| D. | 热水瓶中的水垢的主要成分是CaCO3、MgCO3和Mg(OH)2 |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.3 gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.05NA | |
| B. | 300mL2mol/L蔗糖溶液中所含分子数为0.6NA | |
| C. | 1mol羟基中含有的电子数目为10NA | |
| D. | 1mol Fe与足量H2O(g)反应,转移的电子数为2NA |
14.为验证物质的浓度对化学反应速率的影响,配制1mol•L-1的盐酸置于大烧杯中,并取3mL0.1mol•L-1的Na2S2O3溶液与3mL该盐酸反应,产生明显浑浊约需80s.第二天又用3mL 0.2mol•L-1的Na2S2O3溶液与原盐酸3mL反应,产生浑浊也需80s左右(已知:Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O).下列关于该实验的评价及结论正确的是( )
| A. | 浓度对反应速率的影响不大 | |
| B. | 第二天所用的盐酸浓度较稀 | |
| C. | 该反应用盐酸表示的速率与用硫代硫酸钠表示的速率数值相等 | |
| D. | 任何化学反应,反应时间相同,化学反应速率均相同 |
1.已知短周期元素形成的离子W3+、X+、Y2-、Z- 具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:Y>Z | B. | 离子的还原性:Y2->Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |

 .
. .
.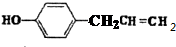 、
、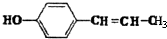 、
、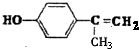 任意2种.
任意2种.