题目内容
【题目】金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:

(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
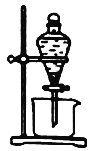
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________
(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:
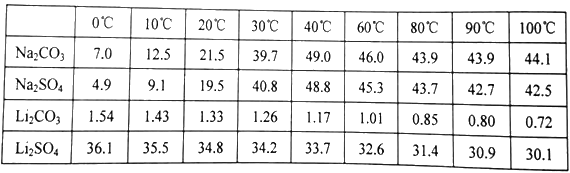
写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、![]() =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
【答案】CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- 2 LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+4H2O+O2↑ 分液漏斗尖端未紧靠烧杯内壁 ;液体过多。 2Li++CO32- =Li2CO3↓ 趁热过滤 3.4 64.9%
【解析】
向废旧锂电池中加入NaOH溶液,Al反应变为NaAlO2进入溶液,LiCoO2不能反应,仍以固体存在,通过过滤进入滤渣;向滤液中通入足量CO2气体,铝元素变为氢氧化铝沉淀析出,向滤渣中加入硫酸和双氧水,其中的金属元素转化为硫酸盐进入溶液;分离混合物时需采用萃取、分液的方法,为充分萃取,溶液不能盛太多,且分液漏斗下端要紧贴烧杯内壁;利用碳酸锂溶解度小的特点,会从溶液中析出;碳酸锂溶解度随温度升高而降低的特点,过滤时要趁热过滤;利用溶度积常数,结合Al3+浓度计算形成沉淀时的pH大小;根据Li2CO3的实际产量占理论产量的百分比计算Li2CO3的产率。
(1)废旧电池中的Al与NaOH溶液反应变为AlO2-进入溶液,向该滤液X中通入过量CO2时,Al元素变为氢氧化铝沉淀析出,发生的主要反应的离子方程式CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(2)废旧电池中的正极材料LiCoO2进入滤渣,向滤渣中加入稀硫酸和双氧水,发生氧化还原反应,两种金属转化为硫酸盐进入溶液,双氧水失去电子变为O2逸出,反应的化学方程式是:2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+4H2O+O2↑;
(3)萃取分离液体为了充分分离,漏斗内液体不能超过2/3,图示分液漏斗内液体量太多,不符合要求;分离互不相容的两层液体时,为防止液滴飞溅,应该使分液漏斗下口紧贴烧杯内壁,使液体沿烧杯内壁流下;
(4)根据图示可知碳酸锂的溶解度比相同温度下的硫酸锂小,而且随温度升高而增大,所以向浓缩后的混合溶液中加入饱和碳酸钠溶液,Li+与CO32-会形成Li2CO3沉淀析出,反应方程式是:2Li++CO32- =Li2CO3↓;为提高Li2CO3的产率,最后过滤时要趁热过滤;
(5)Ksp[Al(OH)3]=c(Al3+)c3(OH-)=1.3×10-33,要形成沉淀,离子浓度的乘积就要大于溶度积常数,所以0.1mol/L×c3(OH-)>1.3×10-33,c3(OH-)>1.3×10-32,解得c(OH-)>![]() =2.35×10-11mol/L,根据室温下水的离子积常数Kw=10-14,可得c(H+)<10-14÷(2.35×10-11)=4.26×10-4mol/L,所以pH>3.4;
=2.35×10-11mol/L,根据室温下水的离子积常数Kw=10-14,可得c(H+)<10-14÷(2.35×10-11)=4.26×10-4mol/L,所以pH>3.4;
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,其中含有钴酸锂质量为m(LiCoO2)=100g×9.8%=9.8g,根据Li守恒,若按照上述生产流程,2mol LiCoO2可以生成1molLi2CO3,关系为2×98:74=9.8g:m(Li2CO3),解得m(Li2CO3)=3.7g,实际得到质量2.4g,所以Li2CO3的产率为(2.4÷3.7) ×100%=64.9%。

【题目】我国某科研团队以N2为原料合成了超高含能材料聚合氮——以氮氮单键(N-N)结合的具有网状结构的聚合体。有关化学键的键能数据如下:
化学键 | N≡N | N=N | N-N |
键能/(kJ/mol) | 946 | 419 | 159 |
下列分析不正确的是
A. 氮原子的结构示意图:![]() B. 聚合氮转变为N2会释放能量
B. 聚合氮转变为N2会释放能量
C. 高温有利于聚合氮的合成 D. 低压有利于聚合氮的合成
【题目】在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
实验 | ① | ② | ③ |
电压 | U1 | U2 | U3 |
现象 | a极产生少量气泡,b极无明显气泡 | a极产生较多气泡,b极产生少量气泡 | a极产生大量气泡,b极逸出大量黄绿色气体 |

下列分析不正确的是
A. ①、②、③中,a极均发生了还原反应
B. ①、②、③中均能发生Cl2+2NaOH =NaCl+NaClO+H2O
C. 电解时OH- 由b极向a极移动
D. 不宜采用实验③的电压制备NaClO


