题目内容
【题目】下列图示与对应的叙述不正确的是( )
A.
图可表示短周期主族元素的原子半径随原子序数的变化规律
B.
图可表示第二周期主族元素最外层电子数随原子序数的变化规律
C.
图可表示CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D.
图可表示一定条件下,合成氨反应正、逆反应速率随时间的变化,则t1~t2 时间:v(正反应)=v(逆反应)≠0
【答案】C
【解析】解:A.同周期从左到右原子半径增大,同主族电子层数越多原子半径越大,所以图中原子半径的变化趋势符合实际,故A正确;
B.同周期从左到右原子的最外层电子数依次增加,所以第二周期元素的原子的最外层电子数随着原子序数增大而增加,故B正确;
C.图中CH4与Cl2的第一步反应中反应物的总能量小于生成物的总能量,即为吸热反应,而第二步为放热反应,故C错误;
D.可逆反应达到平衡状态时,v(正反应)=v(逆反应)≠0,图中t1~t2 时间反应达到了平衡状态,即v(正反应)=v(逆反应)≠0,故D正确.
故选C.
【考点精析】本题主要考查了吸热反应和放热反应的相关知识点,需要掌握化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应才能正确解答此题.

 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】表中对应关系正确的是( )
A | ① | 均为加成反应 |
B | ①CH3CH3+Cl2 | 均为取代反应 |
C | ① | 均为加聚反应 |
D | ①C(s)+CO2(g)═2CO(g) | 均为△H>0的反应 |
A.A
B.B
C.C
D.D
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等. 
(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2 , Na2O2的电子式为 .
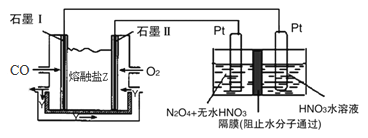
(2)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是 .
(4)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
质量分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | 5.0 | 60℃ | 0 | 0 | |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | 0 | |
Ⅳ | 4.0% | 5.0 | 常温 | 0 | 1.0 | |
填写表中缺少的内容:Ⅱ;Ⅲ;Ⅳ .
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的极(选填:“正”或“负”);纳米棒向(选填:“左”或“右”)移动.
(6)断裂1mol过氧化氢中的O﹣O键和氧气中的O=O键所需的能量依次分别为142kJmol﹣1、497.3kJmol﹣1 . 则反应2H2O2(l)═2H2O(l)+O2(g)△H=kJmol﹣1 .