��Ŀ����
����Ŀ��ijͬѧ��ͼ����ʾװ�ü����ģ��ⶨ̼��������ᷴӦ����CO2��������淴Ӧʱ��仯����������Ƴ�ͼ����ʾ���ߣ��йط�������ȷ���ǣ� �� 
A.CaCO3������ķ�ӦΪ���ȷ�Ӧ
B.�ռ���������ʱ���Ϊt1��t2
C.ƽ����Ӧ���ʣ�v��t1��t2����v��t2��t3����v��0��t1����v��t3��t4��
D.��t4���ռ�����CO2���岻�����ӣ�һ����̼�������ȫ��Ӧ
���𰸡�D
���������⣺A��t1��t2�淴Ӧ�Ľ��У���Ӧ���Ũ���Ǽ�С����������������˵����Ӧ�¶����ߣ��÷�Ӧ���ȣ���A��ȷ��
B������ͼ��֪��б��������t1��t2 �� ����������죬��ͬ��ʱ�����ռ���������࣬��B��ȷ��
C��ͼ����б�ʴ�С��K��t1��t2����K��t2��t3����K��0��t1����K��t3��t4����б�ʾ�Խ��Ӧ����Խ������ƽ����Ӧ���ʣ�v��t1��t2����v��t2��t3����v��0��t1����v��t3��t4������C��ȷ��
D����t4���ռ�������������������ӣ�˵����Ӧ������һ���Ѿ������꣬�������̼�������ȫ��Ӧ����D����
��ѡD��
�����㾫�����������ȷ�Ӧ�ͷ��ȷ�Ӧ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ��

����Ŀ�����Ȼ���(PCl5)���л��ϳ�����Ҫ���Ȼ���,���������Ȼ���(PCl3)�Ȼ��õ�:
PCl3(g)+Cl2(g)![]() PCl5(g)����H=-93.0 kJ��mol-1��ij�¶���,���ݻ��㶨Ϊ2.0 L���ܱ������г���2.0 mol PCl3��1.0 mol Cl2,һ��ʱ���Ӧ��ƽ��״̬,ʵ���������±���ʾ:
PCl5(g)����H=-93.0 kJ��mol-1��ij�¶���,���ݻ��㶨Ϊ2.0 L���ܱ������г���2.0 mol PCl3��1.0 mol Cl2,һ��ʱ���Ӧ��ƽ��״̬,ʵ���������±���ʾ:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0��150 s�ڵ�ƽ����Ӧ����v(PCl3)=________mol��L-1��s-1��
(2)���¶���,�˷�Ӧ�Ļ�ѧƽ�ⳣ������ֵΪ____(���÷�����ʾ)��
(3)��Ӧ��250 sʱ,�÷�Ӧ�ų�������Ϊ________kJ��
(4)���й���������Ӧ��˵����,��ȷ����______(����ĸ)��
a.�����Ƿ��ƽ��״̬,���������ܶ�ʼ�ղ���
b.300 sʱ,�����¶�,�����淴Ӧ����ͬʱ����
c.350 sʱ,����ܱ������г��뵪��,ƽ��������Ӧ�����ƶ�
d.��ͬ������,����ʼ����ܱ������г���1.0 mol PCl3��0.2 mol Cl2,�ﵽ��ѧƽ��״̬ʱ,n(PCl5)<0.20 mol
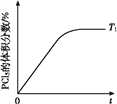
(5)�¶�T1ʱ,���������PCl5�����������ʱ��t�仯��ʾ��ͼ���ϡ�����������ͬ,������ͼ�л����¶�ΪT2(T2>T1)ʱ,PCl5�����������ʱ��仯������________��