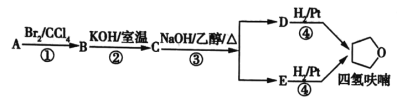
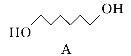
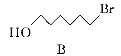
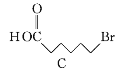
题目内容
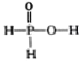
【题目】高铁电池是一种新型可充电电池该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(1)高铁电池的负极材料是___。
(2)放电时,正极发生__(填“氧化”或“还原”)反应;负极的电极反应式为__。
(3)放电时,__(填“正”或“负”)极附近溶液的碱性增强。
【答案】Zn 还原 Zn-2e-+2OH-=Zn(OH)2 正
【解析】
放电时该装置相当于原电池,根据原电池有关原理进行解答。
(1)电池的负极上发生氧化反应,正极上发生还原反应。由高铁电池放电时的总反应方程式可知,负极材料应为Zn。
答案为:Zn。
(2)原电池放电时,正极得到电子发生还原反应,负极材料为锌,失电子发生氧化反应,由总反应可知溶液为碱性,所以负极反应式为:Zn-2e-+2OH-=Zn(OH)2。
答案为:还原;Zn-2e-+2OH-=Zn(OH)2。
(3)放电时K2FeO4中的Fe的化合价由+6价变为+3价,发生还原反应,电极反应式为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-,正极上生成氢氧根离子导致溶液中氢氧根离子浓度增大,溶液的碱性增强。
答案为:正。

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目