题目内容
【题目】工业上用CO生产甲醇的反应为CO(g)+2H2(g)CH3OH(g) △H=akJ/mol.图1表示反应中能量的变化;图2表示一定温度下,在体积固定为1L的密闭容器中加入2molH2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图..下列叙述错误的是( )
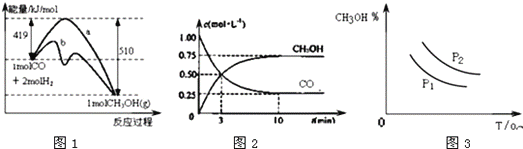
A. CO和H2合成CH3OH的反应:△H<0,△S<0
B. 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C. 图1中曲线b可表示使用了催化剂的能量变化情况
D. 图3中曲线可表示在不同压强P1.P2(P1<P2)条件下甲醇百分含量随温度变化的情况
【答案】B
【解析】试题分析:A.该反应是一个反应前后气体体积减小的放热反应,所以△H<0,△S<0;B.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,反应达到新平衡时n(CH3OH)/n(CO)增大;C.使用催化剂能降低反应需要的活化能从而改变反应途径,但不影响平衡移动,所以放出的能量不变;D.温度一定,压强越大平衡向正反应方向移动,甲醇百分含量越高;压强一定,该放热反应温度越高,平衡逆向移动,甲醇百分含量越低。

 名校课堂系列答案
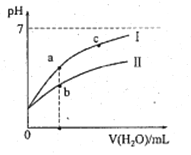
名校课堂系列答案【题目】下表为25℃时某些弱酸的电离平衡常数;下边图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
弱酸的电离平衡常数(25℃) | |
CH3COOH | HClO |
Ka=1.8×10-5 | Ka=3.0×10-8 |
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH-)+c(CH3COO-)>NaClO溶液的c(OH-)+c(C1O-)
