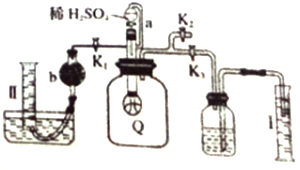
题目内容
【题目】下列说法不正确的是( )
A. 氢能、核能都是无污染的高效能源
B. 把煤转化为液态燃料可提高煤的燃烧效率
C. 推广使用太阳能、风能、海洋能,有利于缓解温室效应
D. 升温,能增大单位体积活化分子百分数,所以反应速率增大
【答案】A
【解析】
A.核能有可能造成核污染,故A说法不正确;
B.把煤转化为液态燃料,例如甲醇等,燃烧更充分,可提高煤的燃烧效率,故B说法正确;
C.推广使用太阳能、风能、海洋能等这些新能源,减少化石能源的使用,有利于缓解温室效应,故C说法正确;
D.升高温度,能增大活化分子百分数,从而单位体积内活化分子百分数增大,所以反应速率增大,故D说法正确;
答案选A。

 习题精选系列答案
习题精选系列答案【题目】废旧电池若不进行回收利用,将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料[由Ni(OH)2、碳粉、Fe2O3等涂覆在铝箔上制成]进行回收研究,设计实验流程如下图所示:
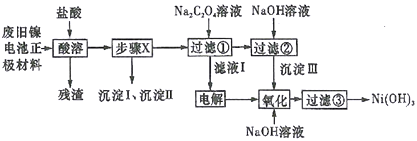
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2能氧化Ni2+为Ni3+;
②NiO+2HCl=NiCl2+H2O;
③Fe3+、Al3+、Ni3+以氢氧化物形式沉淀时溶液的pH如下表所示:
离子 | Fe3+ | Al3+ | Ni2+ |
开始沉淀时的pH | 1.5 | 3.5 | 7.0 |
完全沉淀时的pH | 3.2 | 4.8 | 9.0 |
④Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
请回答下列问题:
(1)酸溶后所留残渣的主要成份__________(填物质名称)。
(2)步骤X的操作为用NiO调节溶液pH,首先析出的沉淀Ⅰ是__________(填化学式),调节过程中pH不能低于___________。
(3)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则加入Na2C2O4溶液后析出的沉淀是__________。
(4)写出生成沉淀Ⅲ的离子方程式__________,该反应的平衡常数为__________。
(5)用化学反应方程式表示沉淀Ⅲ转化为Ni(OH)3________________________。
(6)过滤③后如何检验Ni(OH)3已洗涤干净____________________________。