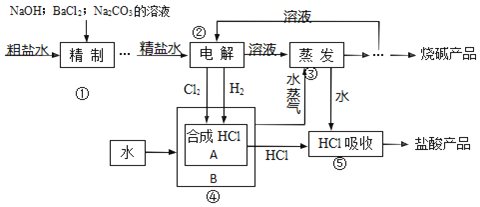
题目内容
【题目】如图装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色.

(1)电源的负极是_____,B中的阳极是_____。
(2)电极质量增加的是_____,A溶液的pH_____(填“增大”“减小”或“不变”)。
(3)B装置用U形管的原因是_________________________。
【答案】X b Pt 不变 防止H2与Cl2混合后发生爆炸
【解析】
a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色,有氢氧根产生,则a是阴极,b是阳极,所以X是负极、Y是正极,Pt是阴极、Cu作阳极,Pt电极上铜离子放电、Cu电极上铜失去电子,为Pt上镀铜,据此分析。
(1)电源的负极是X极,B中的阳极是b极;
(2)Pt上铜离子放电,则电极质量增加的是Pt,Cu电极上铜失去电子,为Pt上镀铜,因此A溶液的pH不变;
(3)B装置中产生氢气和氯气,则B装置用U形管的原因是防止H2与Cl2混合后发生爆炸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO(OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是___。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
a | 7.0 | 8.0 | 9.0 |
FeO(OH)的产率 | <50% | 95% | >95% |
FeO(OH)生成后pH | 接近4 | 接近4 | 接近4 |
用离子方程式解释FeO(OH)生成后溶液pH下降的原因:___。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO(OH)向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeO(OH)向Fe2O3的转化。
①分析,假设i不成立的实验依据是___。
②其他条件相同时,向FeO(OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如表:
c(Fe2+)/molL-1 | FeO(OH)百分含量/% | Fe2O3百分含量/% |
0.00 | 100 | 0 |
0.01 | 40 | 60 |
0.02 | 0 | 100 |
以上结果表明:___。
(3)a=7和a=9时,FeO(OH)产率差异很大的原因是___。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO(OH)红棕色悬浊液中同时加入FeSO4溶波和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3
(4)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___。
②已知N=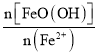 ,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
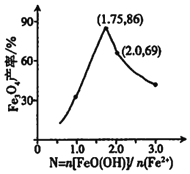
经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___。
【题目】在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)该反应为____________反应(选填吸热、放热),原因是_____________________。
(3)能判断该反应是否达到化学平衡状态的依据是________________(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______________℃。该温度下,若向容器中分别加入2mol H2和2molCO2,10s后达到平衡,则这段时间内υ(H2)=_______________, CO2的转化率为_____________。