题目内容
【题目】已知:还原性HSO3->I-,氧化性IO3-> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目_______。
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为_______(填化学式);
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式_______;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为_______mol。
【答案】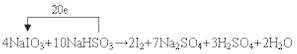 NaI IO3-+5I-+6H+=3I2+3H2O
NaI IO3-+5I-+6H+=3I2+3H2O ![]()
【解析】
(1)根据还原性HSO3->I-,氧化性IO3->I2来判断反应的产物,利用得失电子相等配平方程式;
(2)根据过量NaHSO3溶液的还原性和I2的氧化性能继续发生氧化还原反应来分析反应产物;
(3)根据图象及物质的量的关系来分析反应过程,结合电子守恒、电荷守恒写出离子方程式;根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,5molNaHSO3的溶液消耗NaIO3溶液的物质的量为![]() mol,生成碘离子的量为
mol,生成碘离子的量为![]() mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为
mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为![]() mol,剩余的碘离子的物质的量=(
mol,剩余的碘离子的物质的量=(![]() -
-![]() )mol,当溶液中n(I-):n(I2)=5:3时,即可求出x,最后根据原子守恒可以计算出加入碘酸钾的物质的量。
)mol,当溶液中n(I-):n(I2)=5:3时,即可求出x,最后根据原子守恒可以计算出加入碘酸钾的物质的量。
(1)NaIO3中I元素化合价由+5变为0,NaHSO3中S元素化合价由+4变为+6,根据得失电子守恒、质量守恒,配平反应方程式并标出电子转移的方向和数目为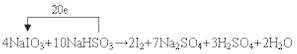 ;
;
(2)氧化剂化合价降低所得产物为还原产物,还原性HSO3->I-,氧化性IO3->I2;在NaIO3与足量NaHSO3溶液反应,NaIO3被还原为NaI,所以还原产物是NaI;
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液,OA段NaHSO3过量,NaIO3被还原为NaI;AB段NaI与NaIO3在酸性条件下发生反应生成碘单质,反应的离子方程式是IO3-+5I-+6H+=3I2+3H2O;根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,5molNaHSO3的溶液消耗NaIO3溶液的物质的量为![]() mol,生成碘离子的量为
mol,生成碘离子的量为![]() mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为
mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为![]() mol,剩余的碘离子的物质的量=(
mol,剩余的碘离子的物质的量=(![]() -
-![]() )mol,当溶液中n(I-):n(I2)=5:3时,即(
)mol,当溶液中n(I-):n(I2)=5:3时,即(![]() -
-![]() ):x=5:3,x=0.5mol,根据原子守恒加入碘酸钾的物质的量=
):x=5:3,x=0.5mol,根据原子守恒加入碘酸钾的物质的量=mol+0.5mol×
![]() mol=
mol=![]() mol。
mol。