题目内容
【题目】Ⅰ.反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
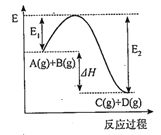
(1)该反应是_____________反应(填“吸热”或“放热”)。
(2)△H=________________(用E1、E2表示)。
Ⅱ.有一种燃料电池,所用燃料为H2和空气,电解质为KOH溶液。回答下列问题:
(3)OH﹣移向________极(填“正”或“负”)。
(4)正极反应式为__________________________。
Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
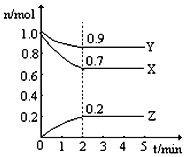
(5)从开始至2min,Z的平均反应速率为________________;
(6)向其中充入1 mol He(g)(He不参加反应),化学反应速率____________(填“加快”“减慢”或“不变”)。
【答案】 放热 -(E2-E1)或E1﹣E2 负 O2+2H2O+4e﹣=4OH﹣ 0.05mol/(L·min) 不变
【解析】
Ⅰ.(1)根据图像可知反应物总能量高于生成物总能量,因此该反应是放热反应。
(2)反应热等于断键吸收的总能量和形成化学键所放出的总能量的差值,则根据图像可知该反应的反应热△H=-(E2-E1)或E1﹣E2。
Ⅱ.(3)原电池中阳离子向正极移动,阴离子向负极移动,则OH﹣移向负极。
(4)原电池的正极发生得到电子的氧化反应,因此氧气在正极通入,又因为电解质溶液显碱性,则正极反应式为O2+2H2O+4e﹣=4OH﹣。
Ⅲ.(5)从开始至2min,Z的物质的量增加了0.2mol,浓度是0.2mol÷2L=0.1mol/L,则Z的平均反应速率为0.1mol/L÷2min=0.05mol/(L·min);
(6)向其中充入1 mol He(g)(He不参加反应),压强增大,但反应物的浓度不变,所以化学反应速率不变。