题目内容
【题目】下列叙述正确的是
A. 向0.1 mol/L的氨水中加水稀释,则溶液中![]() 增大
增大
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. 常温下,将pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈蓝色
D. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
【答案】A
【解析】A.向氨水中加水稀释,促进一水合氨电离,溶液中氢氧根离子的物质的量增大,一水合氨分子的物质的量减少,所以溶液中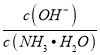 增大,故A正确;B.醋酸的浓度越大其电离程度越小,所以两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2,故B错误;C.醋酸平衡状态下氢离子物质的量和氢氧化钠溶液中氢氧根离子物质的量相同,混合恰好反应后,醋酸又电离出氢离子,溶液呈酸性,使石蕊试液变红色,故C错误;D.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,根据电荷守恒,2c(SO42-)+ c(OH-)=c(NH4+)+ c(H+),pH=7时,c(OH-)=c(H+),则2c(SO42-)=c(NH4+),因此c(SO42-)<c(NH4+),故D错误;故选A。
增大,故A正确;B.醋酸的浓度越大其电离程度越小,所以两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2,故B错误;C.醋酸平衡状态下氢离子物质的量和氢氧化钠溶液中氢氧根离子物质的量相同,混合恰好反应后,醋酸又电离出氢离子,溶液呈酸性,使石蕊试液变红色,故C错误;D.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,根据电荷守恒,2c(SO42-)+ c(OH-)=c(NH4+)+ c(H+),pH=7时,c(OH-)=c(H+),则2c(SO42-)=c(NH4+),因此c(SO42-)<c(NH4+),故D错误;故选A。

练习册系列答案
相关题目