ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΕ‘Ϋπ τ÷ΤΤΖΫχ––ΩΙΗ· ¥¥ΠάμΘ§Ω…―”≥ΛΤδ Ι”Ο ΌΟϋΓΘ“‘œ¬ΈΣ¬Ν≤Ρ±μΟφ¥ΠάμΒΡ“Μ÷÷ΖΫΖ®ΘΚ
Θ®1Θ©Φνœ¥ΒΡΡΩΒΡ «≥ΐ»Ξ¬Ν≤Ρ±μΟφΒΡΉ‘»Μ―θΜ·ΡΛΘ§Φνœ¥ ±≥Θ”–Τχ≈ίΟΑ≥ωΘ§‘≠“ρ «______Θ®”ΟάκΉ”ΖΫ≥Χ Ϋ±μ ΨΘ©ΓΘΈΣΫΪΦνœ¥≤έ“Κ÷–ΒΡ¬Ν“‘≥ΝΒμ–Έ ΫΜΊ ’Θ§ΉνΚΟœρ≤έ“Κ÷–Φ”»κœ¬Ν–÷–ΒΡ______ΓΘ
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
Θ®2Θ©“‘¬Ν≤ΡΈΣ―τΦΪΘ§‘Ύ![]() »ή“Κ÷–ΒγΫβΘ§¬Ν≤Ρ±μΟφ–Έ≥…―θΜ·ΡΛΘ§―τΦΪΒγΦΪΖ¥”Π ΫΈΣ______
»ή“Κ÷–ΒγΫβΘ§¬Ν≤Ρ±μΟφ–Έ≥…―θΜ·ΡΛΘ§―τΦΪΒγΦΪΖ¥”Π ΫΈΣ______
»Γ…ΌΝΩΖœΒγΫβ“ΚΘ§Φ”»κ![]() »ή“ΚΚσ≤ζ…ζΤχ≈ίΚΆΑΉ…Ϊ≥ΝΒμΘ§≤ζ…ζ≥ΝΒμΒΡ‘≠“ρ «______Θ®”ΟΜ·―ß”Ο”οΜΊ¥πΘ©
»ή“ΚΚσ≤ζ…ζΤχ≈ίΚΆΑΉ…Ϊ≥ΝΒμΘ§≤ζ…ζ≥ΝΒμΒΡ‘≠“ρ «______Θ®”ΟΜ·―ß”Ο”οΜΊ¥πΘ©
ΓΨ¥πΑΗΓΩ2Al+2OH-+2H2OΘΫ2AlO2-+3H2Γϋ a 2Al+3H2O-6e-=Al2O3+6H+ Al3++3HCO3-=Al(OH)3Γΐ+3CO2Γϋ
ΓΨΫβΈωΓΩ
Θ®1Θ©”ΟΦν≥ΐ»Ξ¬Ν≤ΡΒΡ―θΜ·ΡΛ ±Θ§Β±―θΜ·ΡΛΆξ»Ϊ»ήΫβΚσΘ§±©¬Ε≥ωΒΡ¬ΝΩ…ΦΧ–χ”κΦνΖ¥”ΠΘ§Ζ≈≥ω«βΤχΘΚ2Al+2OH-+2H2OΘΫ2AlO2-+3H2ΓϋΘΜΦνœ¥≤έ“Κ÷–Κ§”–AlO2-Θ§Ω…Φ”»κΥα–‘Έο÷ ΙΤδΉΣΜ·ΈΣAl(OH)3Θ§”…”ΎAl(OH)3Ω…»ή”Ύ«ΩΥαΘ§Ι ≤ΜΡή―Γ”ΟHNO3Θ§Ι ¥ΥΥα–‘Έο÷ ”Π”ΟCO2ΘΜ
Ήέ…œΥυ ωΘ§±ΨΧβ¥πΑΗ «2Al+2OH-+2H2OΘΫ2AlO2-+3H2ΓϋΘΜaΓΘ
Θ®2Θ©”…Χβ÷––≈œΔΩ…÷Σ¬Ν≤ΡΈΣ―τΦΪΘ§“Σ‘Ύ―τΦΪ…ζ≥…―θΜ·Έο±ΘΜΛΡΛΘ§‘ρ―τΦΪ «¬ΝΖΔ…ζ―θΜ·Ζ¥”ΠΘ§“Σ…ζ≥…―θΜ·ΡΛΜΙ±Ί–κ”–Υ°≤ΈΦ”Θ§Ι ΒγΦΪΖ¥”Π ΫΈΣΘΚ2Al+3H2O-6e-=Al2O3+6H+ΘΜ”…”ΎΒγΫβ“Κ «ΝρΥαΘ§“ρ¥ΥΒγΫβ ±Θ§‘ΎΒγΫβ“Κ÷–Ω…Ρή…ζ≥…“ΜΕ®ΝΩΒΡ¬ΝάκΉ”Θ§¬ΝάκΉ”Υ°Ϋβœ‘Υα–‘Θ§ΧΦΥα«βΗυάκΉ”Υ°Ϋβœ‘Φν–‘Θ§Εΰ’ΏœύΜΞ¥ΌΫχΘ§≤ζ…ζΕΰ―θΜ·ΧΦΤχΧεΚΆ«β―θΜ·¬Ν≥ΝΒμΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚAl3++3HCO3-=Al(OH)3Γΐ+3CO2ΓϋΓΘ
Ήέ…œΥυ ωΘ§±ΨΧβ¥πΑΗ «ΘΚ2Al+3H2O-6e-=Al2O3+6H+ΘΜAl3++3HCO3-=Al(OH)3Γΐ+3CO2ΓϋΓΘ

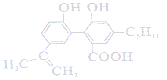
ΓΨΧβΡΩΓΩFe(OH)3ΙψΖΚ”Π”Ο”Ύ“Ϋ“©÷ΤΦΝΓΔ―’Νœ÷Τ‘λΒ»Νλ”ρΘ§Τδ÷Τ±Η≤Ϋ÷ηΦΑΉΑ÷Ο»γœ¬ΘΚ‘Ύ»ΐΨ±…’ΤΩ÷–Φ”»κ16.7gFeSO4ΓΛ7H2OΚΆ40.0ml’τΝσΥ°ΓΘ±ΏΫΝΑη±ΏΜΚ¬ΐΦ”»κ3.0mL≈®H2SO4Θ§‘ΌΦ”»κ2.0gNaClO3ΙΧΧεΓΘΥ°‘ΓΦ”»»÷Ν80ΓφΘ§ΫΝΑη“ΜΕΈ ±ΦδΚσΘ§Φ”»κNaOH»ή“ΚΘ§≥δΖ÷Ζ¥”ΠΓΘΨ≠Ιΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΒΟ≤ζΤΖΓΘ
(1)NaClO3―θΜ·FeSO4ΓΛ7H2OΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_____________ΓΘ
(2)Φ”»κ≈®ΝρΥαΒΡΉς”ΟΈΣ_________(Χν±ξΚ≈)ΓΘ
a.ΧαΙ©Υα–‘ΜΖΨ≥Θ§‘ω«ΩNaClO3―θΜ·–‘ b.Ά―»ΞFeSO4ΓΛ7H2OΒΡΫαΨßΥ°
c.“÷÷ΤFe3+Υ°Ϋβ d.ΉςΈΣ―θΜ·ΦΝ
(3)Φλ―ιFe2+“―Ψ≠Άξ»Ϊ±Μ―θΜ·–η Ι”ΟΒΡ ‘ΦΝ «_________ΓΘ
(4)―–ΨΩœύΆ§ ±ΦδΡΎΈ¬Ε»”κNaClO3”ΟΝΩΕ‘Fe2+―θΜ·–ßΙϊΒΡ”ΑœλΘ§…ηΦΤΕ‘±» Β―ι»γœ¬±μ
±ύΚ≈ | T/Γφ | FeSO4ΓΛ7H2O/g | NaClO3/g | ―θΜ·–ßΙϊ/% |
i | 70 | 25 | 1.6 | a |
ii | 70 | 25 | m | b |
iii | 80 | n | 2.0 | c |
iv | 80 | 25 | 1.6 | 87.8 |
ΔΌm=______ΘΜn=______ΓΘ
ΔΎ»τc>87.8>aΘ§‘ρaΓΔbΓΔcΒΡ¥σ–ΓΙΊœΒΈΣ___________ΓΘ
(5)Φ”»κNaOH»ή“Κ÷Τ±ΗFe(OH)3ΒΡΙΐ≥Χ÷–Θ§»τΫΒΒΆΥ°‘ΓΈ¬Ε»Θ§Fe(OH)3ΒΡ≤ζ¬ œ¬ΫΒΘ§Τδ‘≠“ρ «___
(6)≈–ΕœFe(OH)3≥ΝΒμœ¥Β”Η…ΨΜΒΡ Β―ι≤ΌΉςΈΣ_________________ΘΜ
(7)…ηΦΤ Β―ι÷ΛΟς÷ΤΒΟΒΡ≤ζΤΖΚ§FeOOH(ΦΌ…η≤ΜΚ§ΤδΥϊ‘”÷ )ΓΘ___________ΓΘ
ΓΨΧβΡΩΓΩ±ϊœ© «“Μ÷÷÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΘ§Ω…Ά®ΙΐΕΓœ©¥ΏΜ·Ν―ΫβΜρΕΓœ©”κΦΉ¥ΦώνΚœ÷Τ±ΗΓΘ
ΔώΘ°ΕΓœ©¥ΏΜ·Ν―Ϋβ…ζ≤ζ±ϊœ©ΒΡΖ¥”ΠΖΫ≥Χ Ϋ «2C4H8(g)![]() 2C3H6(g)+ C2H4(g)ΓΘ
2C3H6(g)+ C2H4(g)ΓΘ
(1)“―÷ΣC4H8ΓΔC3H6ΓΔC2H4ΒΡ»Φ…’»»Ζ÷±πΈΣ2710.0 kJ![]() molΘ≠1ΓΔ2050.0 kJ
molΘ≠1ΓΔ2050.0 kJ![]() molΘ≠1ΓΔ1410.0 kJ
molΘ≠1ΓΔ1410.0 kJ![]() molΘ≠1Θ§‘ρΗΟΖ¥”ΠΒΡΠΛHΘΫ_______ kJ
molΘ≠1Θ§‘ρΗΟΖ¥”ΠΒΡΠΛHΘΫ_______ kJ![]() molΘ≠1ΓΘœ¬Ν–≤ΌΉςΦ»ΡήΧαΗΏC4H8ΒΡΤΫΚβΉΣΜ·¬ Θ§”÷ΡήΦ”ΩλΖ¥”ΠΥΌ¬ ΒΡ «_________ΓΘ
molΘ≠1ΓΘœ¬Ν–≤ΌΉςΦ»ΡήΧαΗΏC4H8ΒΡΤΫΚβΉΣΜ·¬ Θ§”÷ΡήΦ”ΩλΖ¥”ΠΥΌ¬ ΒΡ «_________ΓΘ
AΘ°…ΐΗΏΈ¬Ε» BΘ°‘ω¥σ―Ι«Ω
CΘ°‘ω¥σC4H8ΒΡ≈®Ε» DΘ° Ι”ΟΗϋΗΏ–ßΒΡ¥ΏΜ·ΦΝ
(2)Ρ≥Έ¬Ε»œ¬Θ§‘ΎΧεΜΐΈΣ2 LΒΡΗ’–‘Οή±’»ίΤς÷–≥δ»κ2.00 mol C4H8Ϋχ––…œ ωΖ¥”ΠΘ§»ίΤςΡΎΒΡΉή―Ι«ΩpΥφ ±ΦδtΒΡ±δΜ·»γœ¬±μΥυ ΨΘΚ
Ζ¥”Π ±Φδt/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
Ήή―Ι«Ωp/kPa | 4.00 | 4.51 | 4.80 | 4.91 | 4.96 | 5.00 | 5.00 |
‘ρ0~10 minΡΎΠ‘(C4H8)ΘΫ_______ mol![]() LΘ≠1
LΘ≠1![]() minΘ≠1Θ§ΗΟΈ¬Ε»œ¬ΒΡΤΫΚβ≥Θ ΐKΘΫ_______kPaΘ®”ΟΤχΧεΒΡΖ÷―Ι±μ ΨΘ©ΓΘ
minΘ≠1Θ§ΗΟΈ¬Ε»œ¬ΒΡΤΫΚβ≥Θ ΐKΘΫ_______kPaΘ®”ΟΤχΧεΒΡΖ÷―Ι±μ ΨΘ©ΓΘ
ΔρΘ°ΫΪΦΉ¥ΦΉΣΜ·ώνΚœΒΫΕΓœ©Ν―ΫβΙΐ≥Χ÷–…ζ≤ζ±ϊœ©Θ§÷ς“Σ…φΦΑœ¬Ν–Ζ¥”ΠΘΚ
ΔΌ 2C4H8(g)![]() 2C3H6(g)+ 2H4(g) ΠΛHΘΨ0
2C3H6(g)+ 2H4(g) ΠΛHΘΨ0
ΔΎ 2CH3OH(g)![]() C2H4(g) + 2H2O(g) ΠΛHΘΦ0
C2H4(g) + 2H2O(g) ΠΛHΘΦ0
Δέ C2H4(g)+ C4H8(g)![]() 2C3H6(g) ΠΛHΘΦ0
2C3H6(g) ΠΛHΘΦ0
“―÷ΣΘΚΦΉ¥ΦΈϋΗΫ‘Ύ¥ΏΜ·ΦΝ…œΘ§Ω…“‘ΜνΜ·¥ΏΜ·ΦΝΘΜΦΉ¥Φ≈®Ε»Ιΐ¥σ“≤Μα“÷÷ΤΕΓœ©‘Ύ¥ΏΜ·ΦΝ…œΒΡΉΣΜ·ΓΘ
(3)ΆΦ1 «C3H6ΦΑΡ≥–©Η±≤ζΈοΒΡ≤ζ¬ ”κn(CH3OH)/n(C4H8)ΒΡΙΊœΒ«ζœΏΓΘΉνΦ―ΒΡn(CH3OH)/n(C4H8)‘ΦΈΣ_________ΓΘ

(4)ΆΦ2 «Ρ≥―Ι«Ωœ¬Θ§ΫΪCH3OHΚΆC4H8Α¥“ΜΕ®ΒΡΈο÷ ΒΡΝΩ÷°±»ΆΕΝœΘ§Ζ¥”Π¥οΒΫΤΫΚβ ±C3H6ΒΡΧεΜΐΖ÷ ΐΥφΈ¬Ε»ΒΡ±δΜ·«ζœΏΓΘ”…ΆΦΩ…÷ΣΤΫΚβ ±C3H6ΒΡΧεΜΐΖ÷ ΐΥφΈ¬Ε»ΒΡ…ΐΗΏ≥ œ÷œ»…ΐΗΏΚσΫΒΒΆΘ§Τδ‘≠“ρΩ…Ρή «__________________________________________________ΓΘ

(5)œ¬Ν–”–ΙΊΫΪΦΉ¥ΦΉΣΜ·ώνΚœΒΫΕΓœ©Ν―ΫβΙΐ≥Χ÷–…ζ≤ζ±ϊœ©ΒΡΥΒΖ®’ΐ»ΖΒΡ «________ΓΘ
AΘ°‘ω¥σΦΉ¥ΦΒΡΆ®»κΝΩ“ΜΕ®Ω…“‘¥ΌΫχΕΓœ©Ν―Ϋβ
BΘ°ΦΉ¥ΦΉΣΜ·…ζ≥…ΒΡΥ°Ω…“‘Φθ…Ό¥ΏΜ·ΦΝ…œΒΡΜΐΧΦΘ§―”≥Λ¥ΏΜ·ΦΝΒΡ ΌΟϋ
CΘ°ΧαΗΏΦΉ¥Φ”κΕΓœ©ΒΡΈο÷ ΒΡΝΩΒΡ±»÷Β≤ΜΡήΧαΗΏ±ϊœ©ΒΡΤΫΚβΉι≥…
DΘ°ΫΪΦΉ¥ΦΉΣΜ·“ΐ»κΕΓœ©ΒΡΝ―Ϋβ÷–Θ§Ω…“‘ Βœ÷Ζ¥”Π»»–ß”ΠΤΫΚβΘ§ΫΒΒΆΡήΚΡ
ΓΨΧβΡΩΓΩ“―÷Σ25Γφ ±≤ΩΖ÷»θΒγΫβ÷ ΒΡΒγάκΤΫΚβ≥Θ ΐ ΐΨί»γ±μΥυ ΨΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Μ·―ß Ϋ | CH3COOH | H2CO3 | HClO | |
ΒγάκΤΫΚβ≥Θ ΐ | KaΘΫ1.8ΓΝ10Θ≠5 | KalΘΫ4.3ΓΝ10Θ≠7 | Ka2ΘΫ5.6ΓΝ10Θ≠11 | KaΘΫ3.0ΓΝ10Θ≠8 |
(1) aΘ°CH3COONa bΘ°Na2CO3cΘ°NaClO dΘ°NaHCO3ΥΡ÷÷»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»ΨυΈΣ0.1molΓΛLΘ≠1ΒΡΘ§pH”…–ΓΒΫ¥σ≈≈Ν–ΒΡΥ≥–ρ «_______________(”Ο±ύΚ≈Χν–¥)ΓΘ
(2)≥ΘΈ¬œ¬Θ§0.1molΓΛLΘ≠1CH3COOH»ή“ΚΦ”Υ°œΓ ΆΙΐ≥Χ÷–Θ§œ¬Ν–±μ¥ο ΫΒΡ ΐΨί±δ¥σΒΡ «Θ®______Θ©
AΘ°c(HΘΪ) BΘ°c(HΘΪ)/c(CH3COOH) CΘ°c(HΘΪ)ΓΛc(OHΘ≠)
DΘ°c(OHΘ≠)/c(HΘΪ) EΘ°c(HΘΪ)ΓΛc(CH3COOΘ≠)/c(CH3COOH)
(3)ΧεΜΐΨυΈΣ100mL pHΘΫ2ΒΡCH3COOH”κ“Μ‘ΣΥαHXΘ§Φ”Υ°œΓ ΆΙΐ≥Χ÷–pH”κ»ή“ΚΧεΜΐΒΡΙΊœΒ»γΆΦΥυ ΨΘ§‘ρHXΒΡΒγάκΤΫΚβ≥Θ ΐ_____(ΧνΓΑ¥σ”ΎΓ±ΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±)CH3COOHΒΡΒγάκΤΫΚβ≥Θ ΐΘ§άμ”… «_____________________ΓΘ

(4)25Γφ ±Θ§CH3COOH”κCH3COONaΒΡΜλΚœ»ή“ΚΘ§»τ≤βΒΟpHΘΫ6Θ§‘ρ»ή“Κ÷–
c(CH3COOΘ≠)Θ≠c(NaΘΪ)ΘΫ___________________molΓΛLΘ≠1(ΧνΨΪ»Ζ÷Β)ΓΘ